| Preparación de la suspensión
bacteriana |
| Tomar una colonia bien aislada de cada
microorganismo y resuspenderla homogéneamente en 5 mL de solución salina
(1% de NaCl) o 5 mL de agua estéril. |

|
| Siembra de la galería API |
| Cada pocillo tiene un tubo y una cúpula
(parte aerobia). |
|
| Llenar con la suspensión de bacterias
los tubos, no la cúpula, de todos los pocillos. |

|
| Llenar la cúpula de los pocillos
CIT , VP, GEL con la suspensión de bacterias. |

|
| Tapar con parafina líquida |
| Llenar con parafina las cúpulas
de los pocillos ADH, LDC, ODC, URE, H2S para obtener anaerobiosis. |

|
| Poner la galería en su
propia cámara húmeda de incubación |
| Poner la tira en su propia cámara
húmeda de incubación. Previamente poner agua en los alvéolos
de la cámara para proporcionar una atmósfera húmeda durante
la incubación. |

|
| Incubación en estufa |
| Incubar a 37 °C durante 18-24 h. |

|
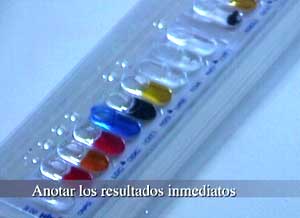
| Anotar los resultados inmediatos |
La lectura de los resultados se lleva
a cabo por comparación de los colores de cada pocillo con los de las tablas
de lectura.
Ver tabla de lectura (colores en imagen) en
otra pantalla
Ver tabla de lectura (colores en texto) en
otra pantalla
Y anotando el resultado como
positivo o negativo |
|
| Revelado de pruebas que requieren
reactivos (Ver
vídeo revelado y lectura API20E) |
|
Para la lectura se tienen en cuenta
los siguientes criterios:
- Si la glucosa da negativo y los
tests positivos son 2 o menos de 2, no hay que añadir reactivos. Cuando ésto
ocurre se hacen otros tipos de API como el API 20NE, API OF, el API M o el API 10S
para ver determinados metabolismos especiales.
- Si la glucosa es positiva y/o 3
o más tests son positivos se revelan los test que requieren reactivos:
|
|
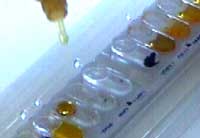
TDA
Añadir una gota de FeCl3 10
%. Positivo = color marrón oscuro.
|
|
|
VP
Añadir una gota del reactivo
1 (KOH al 40%) y una gota del reactivo 2 (C2 H5 OH). Positivo = color rosa fuerte
o rojo en 5-10 minutos.
|

|
|
IND
Añadir una gota de reactivo
de Kovacs (1) o de Dimetilamino-cinamaldehido (2). Dependiendo del reactivo utilizado
pueden darse las posibilidades siguientes:
(1)Positivo = aparece un anillo rosa-rojo
(2)Positivo =color de rosa a morado
en todo el pocillo
|

|
|
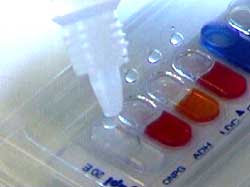
Oxidasa
Añadir una gota del reactivo
(tetrafenilendiamina) recién preparado. Positivo = color azul que aparece
inmediatamente
|
|
| Anotar el resto de resultados |
La lectura de los resultados se lleva
a cabo por comparación de los colores de cada pocillo con los de las tablas
de lectura.
Ver tabla de lectura (colores en imagen) en
otra pantalla
Ver tabla de lectura (colores en texto) en
otra pantalla
Y anotando el resultado como
positivo o negativo |

|
| Perfil numérico e identificación |
|
Del conjunto de reacciones y resultados
se obtiene un perfil numérico de 7 cifras. Los pocillos están separados
en grupos de tres: en total tenemos 7 grupos de tres tubos o tripletes (el test número
21 corresponde al test de la oxidasa). A cada pocillo se le da el valor 0, 1, 2 o
4.
o Si la reacción es negativa
se pone 0.
o Si la reacción es positiva se pone: 1 si es el primer pocillo de un triplete,
2 si es el segundo, 4 si es el tercero.
o Se suman los valores de cada triplete y se obtiene un código de 7 cifras.
o Con este código se busca en la tabla de identificación la especie
de que se trata.
|

|