Manual técnico del agua.
Barraque. Ch., y otros
ed. Degremont. 1979.
TRATAMIENTOS ESPECIFICOS
3.2. Tratamiento específico de eliminación y corrección de aguas naturales
1. ELIMINACIÓN DE HIERRO Y MANGANESO
El hierro y el manganeso deben eliminarse de las aguas de consumo, por diversas razones:
- causas de corrosión o de obstrucción de las tuberías (directamente. Por precipitación y formación de depósitos, o indirectamente, favoreciendo el desarrollo de bacterias específicas);
- aspecto del agua;
- sabor metálico;
- inconveniente en el lavado de la ropa.
Igualmente, son indeseables estos elementos en numerosas aguas de fabricación, en especial en industrias lecheras, papeleras o textiles.
En las aguas de superficie, el hierro y el manganeso se encuentran generalmente en estado oxidado y precipitado, por lo que se eliminan por tratamientos clásicos de clarificación.
En aguas profundas desprovistas de oxígeno, se presentan en forma reducida (estado de oxidación + 2) y disuelta, en cuyo caso deben someterse a los tratamientos específicos que se examinan seguidamente.
A. Estados naturales del hierro y del manganeso - Problemas analíticos
El hierro férrico no complejo se encuentra en estado precipitado; las formas disueltas del hierro, que conducen a los tratamientos estudiados en este capítulo, podrán ser los siguientes:
![]()
con [Fe2+] . [CO23-] = K'FeCO3
y
En presencia de H2S, la solubilidad es menor (debido al bajo valor del producto de solubilidad del sulfuro ferroso que, por ello, precipita).
- minerales: silicatos, fosfatos o polifosfatos. sulfatos, cianuros, etc.;
- orgánicos: podrá tratarse, en realidad, de fenómenos de formación de
complejos propiamente dicha, de quelación o de peptización, en especial con
los ácidos húmicos, fúlvicos, tánicos, etc.
Para definir un tratamiento de desferrización, no basta conocer el contenido total de hierro, sino que deben conocerse igualmente las diferentes formas bajo las cuales puede presentarse este elemento; los diferentes estados del hierro en el agua pueden resumirse de la forma siguiente:
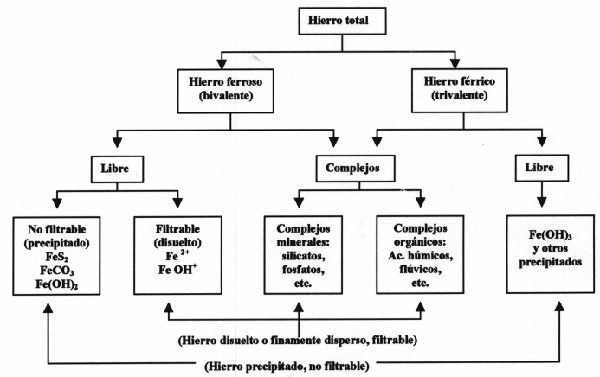
Gráfico: Hierro total
En la práctica, se tendrá ya un conocimiento suficiente del problema, determinando: hierro total, hierro total filtrable, Fe2+ total, Fe2+ filtrante; la eliminación de las formas disueltas planteará problemas, sobre todo en presencia de hierro complejo: si resulta imposible efectuar análisis detallados sobre el terreno, podrá suponerse la presencia de complejos, y por tanto de dificultades de tratamiento, si el contenido total en hierro disuelto es superior al valor de la solubilidad teórica, deducido del pH y de la alcalinidad.
Lo mismo que el hierro, el manganeso puede presentarse bajo diferentes formas: bicarbonatos, complejos minerales y orgánicos, etc. Es preciso efectuar las mismas investigaciones analíticas que para el hierro.
Para abordar cualquier problema de eliminación de hierro o de manganeso, es necesario determinar "in situ" la mayor parte de las características del agua, después de proceder a una explotación suficiente del pozo para asegurarse de la representatividad de la muestra.
La forma del hierro en el agua depende, ante todo, del pH y del potencial de oxidación-reducción; en la figura 419, se ve que el hierro puede pasar de una forma disuelta (por ejemplo, Fe2+ o FeOH+) a una forma precipitada (FeCO3, Fe(OH)2 o Fe(OH)3), al aumentarse el potencial (oxidación), el pH, o ambos. El manganeso sigue una ley análoga. Sobre estos principios se basan, en general, los diferentes tratamientos que se enumeran seguidamente.
B. Tratamiento por oxidación y filtración
Esta técnica es la que se utiliza con mayor frecuencia, especialmente para aguas de pozo. Eventualmente puede añadirse un cierto número de tratamientos suplementarios, tales como: corrección de pH, oxidación química, decantación, etc. Siempre es necesario airear un agua de origen profundo, desprovista de oxígeno, aun cuando se utilice igualmente un oxidante químico.
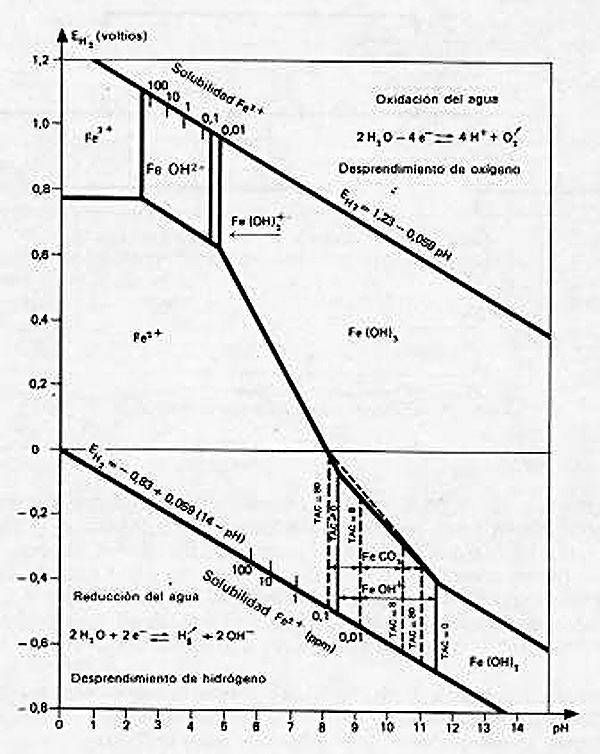
Fig. 419.. - Diagrama «potencial-pH» del hierro (Zonas de existencia de iones y precipitados) según HEM, 1961.
A veces resulta conveniente realizar una precloración, que acelera la oxidación del hierro y permite la eliminación química del amoníaco. Sin embargo, también puede ser contraproducente, si no puede alcanzarse el punto crítico; en efecto, se suprimen entonces ciertas acciones biológicas de desferrización y nitrificación, sin que pueda ejercerse un efecto oxidante suficiente. Por ello, toda precloración debe supeditarse a unos ensayos previos.
Se examinan seguidamente los modelos de aplicación más frecuentes.
B1. Desferrización simple sin decantación (aeración~filtración)
La primera parte del tratamiento de desferrización se basa en una oxidación del hierro bivalente por el oxígeno del aire. Esta aeración puede hacerse:
La ventaja de las instalaciones del segundo tipo consiste en la posibilidad de hacer que trabajen a la presión de impulsión en la red, sin bombeo de recogida Por el contrario, la aeración a la presión atmosférica permite generalmente la evacuación, de forma más económica, del gas carbónico agresivo, que exige un tratamiento costoso de neutralización cuando su contenido es elevado.
La rapidez de la oxidación del hierro bivalente por el oxígeno depende de varios factores, en especial: temperatura, pH, contenidos de hierro y de oxígeno disuelto. La ecuación de la reacción puede escribirse:
![]() (
1 )
(
1 )
y su cinética se expresa por la relación de Stumm & Lee:
-d(Fe2+) = k. (Fe2+). PO2. (OH- )
siendo la constante k función de la temperatura y del poder amortiguador del agua bruta.
La reacción (1) muestra que se necesitan 0,14 mg de oxígeno para oxidar 1mg de hierro. La ecuación (2) muestra que la reacción será tanto más rápida cuanto más elevado sea el pH y cuanto más próxima esté el agua a la saturacion de oxígeno.
El tiempo de oxidación determinado en laboratorio con un agua sintética puede verse considerablemente disminuido en la mayoría de las instalaciones, gracias al efecto catalítico:
- de los sedimentos anteriores;
- de ciertos aniones presentes en el agua, principalmente silicatos y fosfatos;
- eventualmente, de ciertos catalizadores metálicos introducidos en el agua durante el tratamiento: trazas de sulfato de cobre pueden ejercer gran influencia en la oxidación del hierro y del manganeso por el oxígeno o los oxidantes químicos.
Lo mismo sucede con ciertos fenómenos biológicos, que se examinan más adelante. Por el contrario, la presencia de ácidos húmicos retrasa la oxidación del hierro.
Según las técnicas utilizadas, el precipitado formado puede contener mayor o menor proporción de carbonato ferroso, más cristalino que el hidróxido férrico; esta particularidad explica las notables diferencias observadas en el funcionamiento de algunas instalaciones: la talla efectiva del material filtrante puede estar comprendida entre 0,5 y 1 ,7 mm, y la velocidad entre 5 y 20 m3/(m2 .h), si no es más.
También, por las mismas razones, es muy variable el peso de hierro retenido por unidad de superficie filtrante: 200 a 2 500 g de Fe por m2 de arena, según los casos. De forma general. los filtros bicapa (antracita + arena) se adaptan muy bien a la desferrización.
Algunas sustancias, como ácidos húmicos, silicatos, fosfatos o polifosfatos, desempeñan un papel inhibidor en la precipitación y la filtración del hidrato férrico. Pueden combatirse estos efectos por medio de tratamientos complementarios: oxidación (permanganato potásico, ozono), coagulación (sulfato de alúmina) o floculación (alginato), según el caso.
- Una torre de oxidación, que comprende un lecho de lava volcánica muy pura y porosa, que divide el agua y le asegura, por contacto con el aire, una gran superficie de oxidación.
- Un filtro lavable por retorno de agua e inyección de aire. Puede combinarseeste filtro con la torre de oxidación.
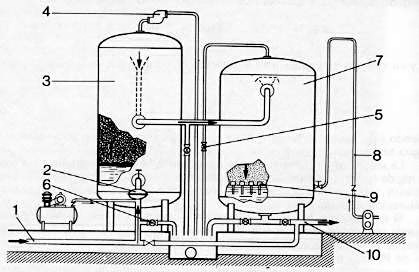
| 1 Llegada de agua bruta | 6 Válvula de vaciado |
| 2 Mezclador de laberinto | 7 Filtro de arena |
| 3 Torre de oxidación | 8 Aire a presión |
| 4 Válvula de evacuación | 9 Fondo con boquillas |
| automática de aire | 10 Salida de agua desferrizada |
| 5 Válvula manual de purga de aire |
Fig. 420 Instalación de desferrización a presión.
Las estaciones por gravedad llevan una aeración a presión atmosférica, seguida de una filtración abierta o cerrada (en este último caso, con o sin bombeo de recogida).
Si el agua bruta presenta, asimismo, un contenido apreciable de amoníaco, puede diseñarse la instalación para realizar simultáneamente una nitrificación y una desferrización: la aeración se realiza entonces en un depósito relleno de lava volcánica, sobre la cual se desarrollan las bacterias nitrificantes. El volumen de este depósito «nitrificador» es función del caudal de agua bruta y de la dosis de amoníaco que haya de eliminarse.
B2. Eliminación de hierro, con decantación.
Es preciso intercalar una decantación, entre la aeración y la filtración, enlos casos siguientes:
- contenido elevado de hierro en el agua bruta, que da lugar a un volumen excesivo de precipitado;
- presencia de color, turbiedad, ácidos húmicos, agentes que dan lugar a complejos, etc., que implica la adición de un coagulante (sulfato de aluminio o cloruro férrico) en dosis superior a unos 10 g/m3 de producto comercial.
Para el tratamiento de estas aguas, es conveniente recurrir a los procesos de decantación por contacto de fangos, que se describen en las páginas 172 y siguientes. La decantación debe ir precedida, necesariamente, de una aeración, si el agua bruta está desprovista de oxígeno.
Teniendo en cuenta que frecuentemente se alimenta una misma instalación a partir de varios pozos, es necesario a veces adaptar el tratamiento para conseguir la combinación más económica: por ejemplo, en la instalación representada en la figura 421, se tratan dos aguas de origen diferente. Una de ellas contiene mucho hierro, que precipita con cal en un decantador Pulsator, mientras que la otra, poco cargada de hierro, se mezcla con la anterior, después de la aeración, por medio de una rampa de pulverización dispuesta, por encima de los filtros.
B3. Eliminación de manganeso.
Cuando un agua bruta contiene manganeso, suele ser en presencia de hierro. Pero los procesos de desferrización que acaban de examinarse, generalmente son insuficientes para la eliminación eficaz del manganeso: la precipitación en forma de hidróxido o la oxidación con oxígeno sólo serían posibles en el caso de un pH demasiado alcalino (9 a 9,5 como mínimo); a veces es posible la oxidación con cloro, pero en presencia de un fuerte exceso de cloro, que debe neutralizarse seguidamente.
Por el contrario, se obtiene una oxidación suficientemente rápida con dióxido de cloro, permanganato potásico u ozono, que llevan al manganeso bivalente al estado de oxidación + 4 y lo precipitan en forma de dióxido de manganeso:
Mn2+ + 2 C102 + 2 H20 MnO2 + 2 02 + 2 Cl- + 4 H+
3Mn2+ + 2MnO4- + H2O 5MnO2 +4H+
Mn2+ + 03 + H20 MnO2 + 02 + 2 H+
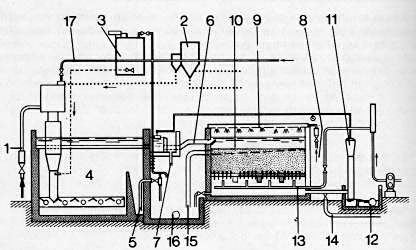
| 1 Entrada de agua bruta con gran | 10 Filtro abierto |
| contenido de hierro | 11 Sifón de regulación del caudal del |
| 2 Dosificador de cal | filtro |
| 3 Dosificador de coagulante | 12 Salida de agua filtrada desferrizada |
| 4 Decantador PULSATOR | 13 Llegada de aire a presión, de lavado |
| 5 Concentración y extracción de fangos | del filtro |
| 6 Salida de agua decantada | 14 Agua de lavado del filtro |
| parcialmente desferrizada | 15 Evacuación de fangos de lavado |
| 7 Rebose | del filtro |
| 8 Entrada de agua bruta con poco | 16 Salida general de fangos |
| contenido de hierro | 17 Llegada de agua a presión |
| 9 Rampa de difusión |
Fig. 421. - Instalación de desferrización de dos aguas con distinto contenido de hierro.
Según estas reacciones, las cantidades teóricas de oxidante que deben utilizarse son, respectivamente, para 1 mg/l de Mn (II):
Dióxido de cloro (ClO2): 2,5 mg/l
Permanganato potásico (KMnQ4): 1,9 mg/l
Ozono (O3): 0,87 mg/l
En efecto, la dosis real puede desviarse sensiblemente de estos valores, en función, sobre todo, del pH, pero también del tiempo de contacto, de la presencia de sedimentos anteriores, del contenido de materias orgánicas, etc. En la práctica, esta dosis estará comprendida entre una y seis veces el contenido de manganeso, en el caso del permanganato potásico, una vez y media y diez veces en el caso del dióxido de cloro, y una vez y media y cinco veces en el caso del ozono.
La dosis exacta de tratamiento sólo puede determinarse experimentalmente. Generalmente, se conseguirá un notable ahorro de oxidante químico, aplicándolo después de una aeración, la cual habrá actuado ya anteriormente sobre las sustancias fácilmente oxidables, especialmente sobre el hierro (II) y el sulfuro de hidrógeno.
Desde el punto de vista tecnológico, estos procesos de oxidación enérgica del manganeso pueden aplicarse en las mismas instalaciones (por gravedad o a presión) que las que se han citado anteriormente para la desferrización, con o sin decantación; sólo se trata entonces de añadir un reactivo suplementario. Las figuras 422 y 423 muestran ejemplos de instalaciones por gravedad, con filtros de hormigón, en las que la desferrización puede ir acompañada de una eliminación de manganeso, coagulación-floculación y ajuste de pH. A veces, el punto exacto de inyección de los reactivos sólo puede determinarse en el transcurso de la explotación.
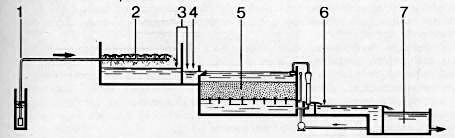
| 1 Bombeo a distancia de agua bruta y | 4 Coagulante y/o floculante eventuales |
| precloración eventual | Complemento de oxidación con |
| 2 Aeración y eliminación de CO2 por | KMnO4 si el agua contiene manganeso |
| pulverización | 5 Filtro de arena (o, eventualmente, |
| 3 Corrección eventual de pH (a efectuar | bicapa), por gravedad |
| antes o después de oxidación comple- | 6 Desinfección con cloro |
| ta, según el caso; el punto de inyec- | 7 Depósito de agua tratada |
| ción exacto se determinará, por lo | |
| tanto, durante la explotación) |
N.B. Para aguas que contengan manganeso, la aeración (en 2) y el complemento de oxidación (en 4) pueden sustituirse por un pretratamiento con ozono.
Fig. 422. - Eliminación de hierro y manganeso en estación abierta, por aeración y filtración.
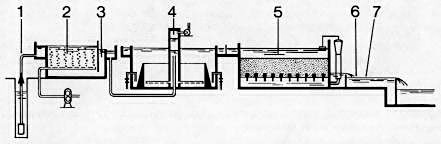
| 1 Bombeo de agua bruta | 4 Floculación, clarificación, desferriza- |
| 2 Aeración | ción |
| 3 Inyección de coagulante y, eventual- | 5 Filtración |
| mente, ayudante. En caso necesario, | 6 Corrección del pH eventual |
| ajuste del pH y complemento de | 7 Desinfección |
| oxidación con KMnO4 o ClO2 |
N.B. Para aguas que contengan manganeso, la aeración (en 2) y el complemento de oxidación (en 3) pueden sustituirse por un pretratamiento con ozono.
Fig. 423. - Eliminación de hierro y manganeso por aeración, decantación y filtración.
La eliminación de manganeso puede exigir modalidades especiales en ciertos casos:

Fig. 424. - Estación de desferrización y neutralización del cuartel de OBERHOFFEN, en Haguenau (Francia). Caudal 60 m3/h.
Documento anterior Pαgina siguiente Νndice