C. Tratamiento asociado a una descarbonatación
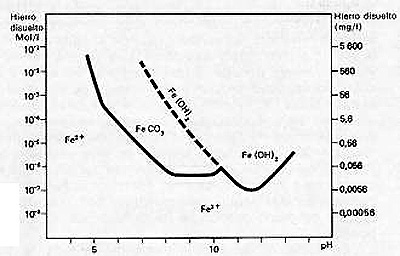
La descarbonatación con cal, que produce un pH elevado, favorece la eliminación del hierro y del manganeso. La precipitación del carbonato ferroso es prácticamente total a pH 8,2, y la del hidróxido ferroso a pH 10,5 (ver figura 425). En presencia de un potencial Redox elevado, el hierro (II) disuelto puede precipitar en forma de Fe(OH)3.
Fe2+ + 3 H2O ‡ Fe(OH)3+ 3 H+ + e-
Para el manganeso, los valores del pH de precipitación son del orden de 9,2 para el carbonato y de 11,5 para el hidróxido, respectivamente.
Por lo tanto, una descarbonatación parcial, a pH próximo a 8, puede producir una desferrización completa. En ciertos casos, especialmente en aparatos de descarbonatación catalítica, se consigue, con el mismo pH, una eliminación suficiente de manganeso, sí bien, teóricamente, habría de combinarse con una descarbonatación total a pH 9,5 ó 10.
El funcionamiento de la instalación realizada en Ratingen, Alemania Federal, para 1000 m3/h, (ver fig. 426), se basa en este principio. En esta instalación se efectúa simultáneamente la descarbonatación, desferrización, eliminación de manganeso y nitrificación.

Fig. 425.-Solubilidad del hierro en función del pH, en un agua de alcalinidad media.
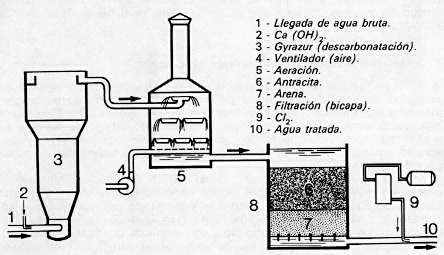
Fig. 426. - Descarbonatación parcial, aeración, filtración.
Esquema de principio de la instalación de RATINGEN (Rep. Fed. de Alemania).
D. Tratamientos biológicos
El metabolismo de algunos microorganismos autótrofos se basa en la oxidación del hierro y del manganeso; en condiciones favorables, las reacciones son muy rápidas y la eliminación de estos dos elementos es completa. El nitrógeno amoniacal es un elemento esencial de la nutrición bacteriana, por lo que la presencia de amoníaco en el agua bruta favorece este tipo de tratamiento (por otra parte, generalmente se produce una nitrificación simultánea).
En su principio, estos tratamientos biológicos no difieren esencialmente de la oxidación-filtración que se ha examinado anteriormente; pero, en su realización, presentan ciertas particularidades en lo que concierne al contenido de oxigeno, la velocidad de filtración y la talla efectiva de la arena.
Esta técnica, que se aplica especialmente en Holanda y en Alemania, resulta interesante, sobre todo, cuando el agua bruta contiene simultáneamente hierro, manganeso y amoníaco. Los filtros secos constituyen su ejemplo más conocido; asimismo, da lugar a instalaciones de filtración doble, cuya secuencia es: adición de un caudal muy pequeño de aire al agua bruta (en función del potencial Redox), desferrización en una primera etapa de filtración, aeración intensiva, eliminación de manganeso en una segunda etapa de filtración (los microorganismos que óxidan el manganeso sólo pueden desarrollarse cuando es muy pequeño el contenido de hierro). Pero nunca se tiene «a priori» la certeza del desarrollo de los microorganismos, por lo que a veces resulta difícil controlar el funcionamiento de las instalaciones proyectadas según este principio: por lo tanto, sólo puede elegirse este tipo de procesos cuando se ha demostrado su fiabilidad, mediante ensayos previos.
En realidad, no está claramente definida la frontera entre oxidación puramente química y tratamiento biológico, por lo que el buen funcionamiento de muchas instalaciones del primer tipo se debe al desarrollo de microorganismos.
E. Filtración a través de materiales especiales
Ciertos productos, tales como pirolusita, CZ, etc., pueden incluirse dentro de esta categoría. Pero estas técnicas sólo son aplicables a pequeñas instalaciones, y con dosis reducidas de hierro y manganeso, en un agua desprovista de materia orgánica, que son poco frecuentes en Europa.
Si se ha sometido al agua bruta a una aeración previa, los materiales recubiertos de MnO2 pueden ejercer igualmente un efecto catalítico sobre la oxidación del hierro y del manganeso con oxígeno; en este caso, no se produce transformación del dióxido de manganeso, por lo que la regeneración no es necesaria.
F. Magnesia en polvo y diatomeas
Este procedimiento consiste en introducir magnesia en polvo en el agua bruta, después de una aeración, y en filtraría a través de diatomeas. La magnesia actuaría de forma triple:
- adsorción del ion ferroso sobre el polvo de magnesia;
- precipitación de Fe(OH)2 y FeCO3;
- catálisis de la oxidación del hierro con oxígeno (fenómeno preponderante).
Esta técnica, de difícil aplicación, no se ha puesto en práctica en instalaciones importantes.
En resumen, los tratamientos de eliminación de hierro y manganeso son generalmente delicados, y al mismo problema pueden aplicarse soluciones diversas. Ante todo, es preciso hacer un planteamiento correcto del problema: se necesita tener un profundo conocimiento de las características del agua bruta, y los ensayos previos, en instalaciones piloto, son en este caso aún más útiles que en el tratamiento de aguas de superficie.
3.2.2. NEUTRALIZACIÓN - REMINERALIZACIÓN
Si un agua natural o tratada no se encuentra en equilibrio carbónico y contiene gas carbónico agresivo, debe preverse su neutralización.
Esta neutralización se realiza por aeración, por adición de reactivos alcalinos (cal, sosa, carbonato sódico) o por filtración sobre productos alcalinotérreos (mármol, Neutralite, Akdolite, Magno, etc.). Estos tratamientos, con excepción de la aeración, dan lugar a un incremento de la mineralización del agua. Si esta mineralización es insuficiente para evitar que el agua sea corrosiva frente a las conducciones metálicas, aunque se encuentre en equilibrio carbónico, debe efectuarse una mineralización complementaria.
Normalmente, la aeración se practica a la entrada de la instalación, en tanto que la neutralización química por reactivo alcalino puede efectuarse:
- a la salida de la instalación, al final del tratamiento;
- parcialmente a la entrada (ajuste del pH de floculación, por ejemplo), con introducción del complemento de tratamiento a la salida de la instalación;
- con menor frecuencia, totalmente a la entrada de la instalación.
Por lo que se refiere a la remineralización, se hace normalmente al final del tratamiento (en el caso de aguas dulces o que hayan sufrido un tratamiento de desalinización por ósmosis inversa u otro procedimiento).
3.2.3: DESCARBONATACIÓN - DESENDURECIMIENTO
Para reducir la dureza del agua, debida generalmente a un exceso de calcio, puede efectuarse un desendurecimiento por resinas intercambiadoras de iones, o por descarbonatación con cal.
En el abastecimiento público de agua, sólo está autorizado el empleo de resinas catiónicas del tipo sulfónico; en Francia, las resinas aniónicas no están admitidas oficialmente.
Las resinas catiónicas intercambian sus iones sodio con los iones calcio del agua. No se modifica su grado alcalimétrico ni su contenido en sulfatos y cloruros; la mineralización cálcica es sustituida por una mineralización sódica.
Se obtiene así agua con un grado hidrotimétrico nulo, que no es agradable para la bebida. Es preferible mantener un cierto TH residual (8 a 15 ºF), desendureciendo únicamente una parte del caudal, que se mezcla, a continuación, con el caudal restante.
El interés de este tratamiento consiste en que no produce residuos sólidos y puede efectuarse a presión. En el caso de grandes caudales, puede realizarse fácilmente el tratamiento por intercambiadores de iones de marcha continua, según el procedimiento E.C.I.-DEGRÉMONT.
Cuando un agua es dura (fuerte grado hidrotimétrico) y presenta además un grado alcalimétrico completo (TAC) elevado, puede desendurecerse por descarbonatación con cal. Esta descarbonatación puede efectuarse:
- de forma catalítica, en un Gyrazur, si no es necesario realizar una clarificación simultánea y si el contenido de magnesio es bajo;
- en un decantador, en los casos restantes.
Se utiliza, como reactivo de clarificación, cloruro férrico. El sulfato de alúmina, al pH del tratamiento, daría lugar a una solubilización de la alúmina que podría flocular más adelante.
En este tratamiento, y por las mismas razones indicadas anteriormente, es necesario, en el caso de un agua potable:
- descarbonatar sólo una parte del caudal y mezclarla con el resto que, eventualmente, deberá ser también clarificado;
- o descarbonatar parcialmente el agua, al mismo tiempo que se clarifica. Se observa, en este caso, que es necesario adoptar en los decantadores velocidades ascensionales tanto menores cuanto menos completa es la descarbonatación Además, el pH puede ser demasiado elevado, siendo necesario corregirlo.
En el caso de aguas con mucha dureza permanente, puede combinarse una descarbonatación con cal con un desendurecimiento con carbonato sódico con lo que se consigue, después de alcanzar el TAC mínimo, precipitar el calcio de los sulfatos y cloruros y reducir el TH. Para que el agua sea agradable para la bebida, debe contener un cierto TAC, por lo que se mezcla con una porción de agua no descarbonatada.
3.2.4 ELIMINACIÓN DE SULFATOS Y CLORUROS
Puesto que no está autorizada la eliminación de sulfatos y cloruros mediante resinas intercambiadoras de iones en el tratamiento de un agua potable, deben utilizarse otros procedimientos que, si bien exigen gastos de primera instalación superiores a los de las resinas intercambiadoras de iones, tienen la ventaja de que sus gastos de explotación son menores.
En el caso de grandes, caudales de agua de mar, o de aguas salobres, se emplea normalmente la desalinización por destilación instantánea («flash»). Una solución más simple en el caso de caudales pequeños y medios, es la desalinización a través de membranas, que pueden realizarse por dos procedimientos principales:
La electrodiálisis puede aplicarse a caudales que pueden llegar a varios millares de m3/dia.
Otra diferencia fundamental: puede tratarse un agua de salinidad inferior a 500 mg/l con un grado muy fuerte de reducción de su mineralización (e independientemente de la salinidad inicial) y un gasto muy pequeño de energía Este procedimiento se adapta lo mismo a las aguas muy concentradas, como es el agua de mar, que a las poco salinas cuya calidad se quiere mejorar.
3.2.5 FLUORURACIÓN Y ELIMINACIÓN DEL FLÚOR
Debe preferirse el término «fluoruración» al de «fluoración» ya que el reactivo que se dosifica es el fluoruro. En cambio puede decirse «cloración» porque lo que se dosifica es el cloro.
Se considera, generalmente, que un contenido pequeño de flúor en el agua de abastecimiento (0,4 a 1 mg/l) favorece la formación del esmalte dental y protege los dientes contra la caries.
Por el contrario, un exceso de flúor produce la destrucción del esmalte dental y un conjunto de alteraciones de carácter endémico, que se agrupan bajo el nombre de «fluorosis»: deformaciones dentales, manchas del esmalte, descalcificación, mineralización de los tendones, molestias digestivas y nerviosas, etc.
Estos defectos se manifiestan, según los individuos, con unos contenidos muy variables de flúor en el agua. Es necesario desechar o tratar las aguas que contengan más de 1 a 1,5 mg/l, expresado en flúor.
Se comprende, por tanto, que pueda preverse, según los casos, una aportación artificial, o la eliminación de este elemento.
A. Fluoruración
Acogiéndose al dictamen favorable de la O.M.S. se practica especialmente en U.S.A.; pueden citarse algunos otros casos aislados en Europa, Australia, América del Sur, etc. Este tratamiento, sin embargo, no tiende a generalizarse todavía ya que no está libre de riesgo y encuentra mucha oposición. Pueden utilizarse los siguientes productos:
- hexafluorosilicato sódico: Na2SiF6, que es el que se emplea con mayor frecuencia;
- ácido hexafluorosilícico: H2SiF6;
- fluoruro sódico: NaF;
-con menor frecuencia: hexafluorosilicato amónico: (NH4)2SiF6; ácido fluorhídrico: HF;
hexafluorosilicato magnésico: MgSiF8; fluoruro cálcico: CaF2 elegirá el producto en función de la cantidad total que haya de distribuirse, y de las condiciones económicas locales.
Se regula el tratamiento (teniendo en cuenta las posibles fluctuaciones del contenido inicial del agua bruta, si no es nulo) de forma que se obtenga un contenid6 en flúor comprendido entre 0,4 y 1 mg/l, según el clima del país considerado.
En este tratamiento, deben tomarse todas las precauciones necesarias con respecto a la protección del personal de la instalación y a la eventualidad de una sobredosificación accidental.
B. Eliminación del flúor
En algunas aguas naturales se encuentra hasta 1O mg/l de flúor. Debe reducirse este contenido hasta 1 mg/l aproximadamente (el limite admisible es tanto menor cuanto mayor es la temperatura media anual).
Los procedimientos que se emplean son:
B 1. Tratamiento con fosfato tricálcico: Desde hace mucho tiempo, se
ha advertido la afinidad del flúor por este cuerpo, ya que se encuentran siempre
contenidos apreciables de flúor en los fosfatos naturales, como los apatitos,
las fosforitas (2 al 5 %), así como en los huesos. Parece que en el apatito,
de fórmula 3 Ca3(P04)2, CaCO3,
el ion carbonato ha sido reemplazado por el flúor para dar el fluorapatito
insoluble. El mismo papel de intercambiador de iones desempeña el hidroxiapatito
(en el que el CaCO3 es reemplazado por Ca(OH)2), que puede
regenerarse indefinidamente con sosa, que transforma el fluorapatito en hidroxiapatito.
En la práctica, se utilizan:
Estas sustancias pueden añadirse, en forma de polvo fino, al agua a tratar: por otra parte, su acción puede combinarse entonces con la del sulfato de aluminio. Pero, generalmente, es preferible acondicionarías de forma que se constituya un material filtrante, que debe regenerarse periódicamente.
B 2. Tratamiento con alúmina: puede utilizarse sulfato de aluminio,
pero la dosis necesaria es muy elevada: 150 a 1000 g/m3,
según los casos. El agua así tratada puede contener una dosis muy fuerte
de aluminio disuelto; hay que prever una floculación posterior al hacer el
ajuste del pH.
La filtración sobre alúmina activada ya se ha practicado con éxito; la regeneración se hace con sulfato de aluminio, o con sosa y ácido sulfúrico. La capacidad de retención puede ser muy variable, según el contenido inicial de fluor en el agua bruta y las condiciones de funcionamiento: 0,3 a 4,5 g de ion F- por litro de producto.
B 3 Desendurecimiento del agua con cal: puede emplearse este método
si el agua tiene un contenido suficiente en magnesio, ya que el hidróxido
magnésico formado es el que adsorbe el flúor. En caso contrario, hay
que enriquecer fuertemente el agua en magnesio por adición de sulfato magnésico
o utilizando cal dolomítica.
Se estima que son necesarios 50 mg/l de magnesio para eliminar 1 mg/I de flúor.
B 4 Filtración sobre carbón activo: este tipo de tratamiento
(regeneración con sosa y gas carbónico) sólo puede aplicarse
si se trabaja en medio muy ácido (en principio, pH 3, como máximo)
y se practica seguidamente una recarbonatación, lo que le hace inaplicable
en la mayoría de los casos.
B 5. Otros procedimientos: si el ion fluoruro ha de eliminarse coincidiendo
con una mineralización excesiva del agua, la ósmosis inversa puede
representar una solución específica de este problema particular. Igualmente,
existen procedimientos electroquímicos con ánodo de aluminio, de los
cuales, sin embargo, todavía no se tiene noticia de aplicación industrial
importante.
En todos los casos, para definir. el tratamiento más conveniente, deberán realizarse ensayos previos (si es posible, sobre el terreno), así como un estudio económico.
En resumen, el conjunto de las técnicas que acaban de enumerarse puede conducir a procesos que incluyan una decantación o una filtración; este último tipo, sobre todo, es el que ha dado lugar a algunas realizaciones industriales, estando constituidos los materiales filtrantes más frecuentes por productos a base de fosfato tricálcico (negro animal o productos sintéticos), o por alúmina activada.
Página anterior Página siguiente Índice