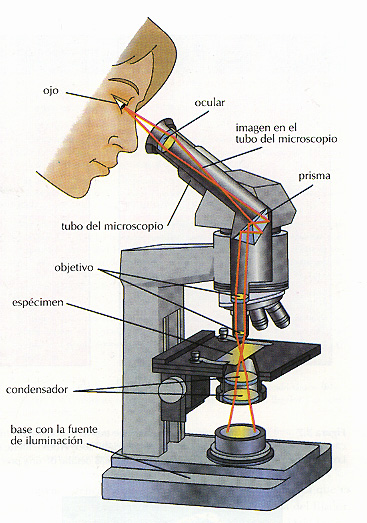
Las partes de un microscopio Los dos sistemas de lentes de un microscopio óptico compuesto se denominan lente objetivo, la que está mas cercana al espécimen, y lente ocular, que está en la pieza del ocular del microscopio. Los microscopios modernos llevan la fuente de luz incorporada. En la Figura 3.6 se puede observar el recorrido de la luz desde la f'uente luminosa, en la base del microscopio, hasta el ojo del obsenador. La luz pasa frecuentemente a través de un filtro azul (para eliminar Iongitudes de onda largas) y a través de otra serie de lentes que constituven el condensador. El condensador tiene como función dirigir la luz sobre el espécimen, donde parte de la misma es absorbida y parte difractada. La luz transmitida entra en la lente objetivo, que forma una imagen en el tubo del microscopio. Posteriormente la lente ocular aumenta la imagen y la proyecta en la última lente de la serie la de nuestro propio ojo. El ojo forma una imagen en la retina y el cerebro la percibe.
Un microscopio compuesto ordinario proporciona una iluminación de campo claro. Esto es debido a que el condensador dirige la luz a través del espécimen, y el fondo queda iluminado de forma brillante. Los microscopios compuestos pueden ser modificados para ver un espécimen mediante (1) contraste de fases, (2) campo oscuro, (3) fluorescencia, o (4) por contraste diferencial de interferencia (Nomarsky); todos estos métodos se describirán más tarde.
Poder total de aumento Casi todos los microscopios compuestos poseen varias lentes objetivos, cada una con un poder de aumento diferente. Normalmente, existe una lente de bajo poder (objetivo débil seco) que aumenta un objeto 10 veces (l0x), una de alto poder (objetivo fuerte seco), que aumenta 40 veces (40x) y el objetivo de inmersión, 100 veces (l00x). Casi todas las lentes del ocular proporcionan un aumento adicional de 10 veces (l0x). Se puede calcular el poder total de aumento de un microscopio multiplicando cl aumento que proporcionan las dos lentes, objetivo y ocular, en uso. (Véase la Tabla 3.1, en la cual se incluyen tres ejemplos.) Si se desea observar la apariencia general de un espécimen es recomendable usar un objetivo de bajo poder, porque su campo de visión es grande. El objetivo de inmersión tiene un campo de visión pequeño, pero proporciona mas detalles de la imagen (Figura 3.7).
Casi todos los microorganismos requieren, antes de ser examinados en un microscopio óptico, una preparación especial; esto es debido a que poseen poco contraste natural. La preparación y la tinción (tratamiento con colorantes) de un espécimen son fundamentales si se desea obtener buenas imágenes. Muchas décadas de esfuerzos y errores han conducido a métodos generales de preparación que resultan idóneos. A continuación describiremos la observación en fresco de microorganismos vivos y varios tipos de tinciones.
| Tabla 3.1. Aumento Total |
|
||||
|---|---|---|---|---|---|
| Microscopio | Lente objetivo | Lente ocular | Ampliación total | ||
| Microscopios ópticos | |||||
| Debil seco |
10x |
x |
10x |
= |
l00x |
| Fuerte seco |
40x |
x |
10x |
= |
400x |
| Aceite de inmersión |
100x |
x |
10x |
= |
1000x |
| Microscopios electrónicos | |||||
| Transmisión (MET) |
~200000x |
||||
| Barrido (MEB) |
~10000x |

Figura 3.6 El camino de la luz en el microscopio compuesto. La luente de luz está en la base. El condensador enfoca el haz de luz sobre el espécimen, donde parte se absorbe, parte se refracta, y parte se transmite. La luz transmitida penetra en la lente objetivo, que aumenta la imagen. El prisma hace que la imagen se forme en el tubo del microscopio, haciendo la visión más cómoda. La lente ocular vuelve a aumentar la imagen y la enfoca en el ojo.
3.1.4 Preparaciones en fresco
La forma más simple de preparar un espécimen para su examen microscópico es hacer una preparación en fresco. Existen dos técnicas, una preparación en fresco simple ("entre porta y cubre") consiste en colocar una gota de líquido con los microorganismos sobre un portaobjetos y a continuación cubrirla con un cubreobjetos. Una preparación en gota pendiente se realiza colocando una gota del material en un cubreobjetos y cubriéndolo con un portaobjetos (invertido) con una excavación central (portaobjetos excavado) (Figura 3.8). Hay que sellar la preparación con vaselina alrededor de la excavación. La ventaja de esta última técnica, es que la preparación no se seca y puede ser observada durante un tiempo más largo.
Las preparaciones en fresco se utilizan para observar microorganismos vivos. Por ejemplo, para la búsqueda de Trichomonas vaginalis en secreciones vaginales. Este protozoo de gran movilidad causa inflamación de la vagina y la uretra. Si en la preparación se observan células en forma de huso que se mueven mediante contracciones o sacudidas cruzando el campo, probablemente se tratará de T. vaginalis, pudiéndose efectuar el diagnóstico.
Sin embargo, el inconveniente de la observación en fresco es que no permite aumentar el contraste de la preparación. Por tanto, su uso, con un microscopio óptico de campo claro, está bastante limitado. Normalmente, para observar microorganismos vivos se utiliza alguno de los otros microscopios ópticos que hemos mencionado anteriormente.

Figura 3.7 El microscopio compuesto tiene tres lentes objetivos (tres sistemas de lentes). Se muestra el mismo campo de Bacillus subtilis visto con el objetivo débil seco (100x), fuerte seco (400x), y con el de inmersión (l000x). Los aumentos mayores revelan progresivamente más detalle de una porción de campo menor.
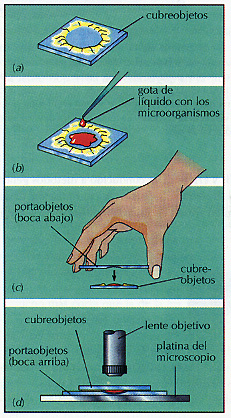
Figura 3.8 Preparación en gota pendiente. Esta preparación se realiza colocando una gota de la suspensión bacteriana en un cubreobjetos en el cual se ha hecho previamente un círculo con vaselina o parafina (a). La vaselina actúa como sellador. (b) Sobre el cubreobjetos se coloca un portaobjetos con una excavación central que queda adherido gracias a la vaselina (c). Se invierte la preparación y se observa colocándola en la platina del microscopio (d). Las preparaciones en gota pendiente se utilizan para observar microorganismos vivos.
3.1.5 Tinciones
El microscopio de campo claro es más útil para la observación de especímenes teñidos. Los colorantes son compuestos químicos utilizados para aumentar el contraste. Existen algunos, llamados colorantes vitales, que pueden añadirse directamente a una preparación en fresco; por tanto, colorean células vivas. No obstante, la mayoría de los colorantes son solamente efectivos después de que los microorganismos hayan sido fijados, es decir, se encuentren muertos y adheridos al portaobjetos. Para la fijación por calor, se realiza una fina extensión de una gota de muestra líquida sobre un portaobjetos y se deja secar al aire; a continuación, se pasa la preparación de Forma rápida sobre la llama de un mechero. El calor de la llama mata las células microbianas por desnaturalización de sus proteínas. Las proteínas coaguladas unen las células al porta. Cuando se desea fijar especimenes delicados se utiliza la fijación química, va que es menos lesiva que el calor. Para ello se añade una gota del fijador, por ejemplo, ácido ósmico, formaldehído, o glutaraldehído, sobre la muestra líquida con los microorganismos.
La fijación posee algunos inconvenientes. Por ejemplo, a menudo distorsiona la apariencia real de las células, lo cual dificulta la identificación; además, no permite la observación del movímiento de los microorganismos. Después de la fijación, se añade el colorante, que debe permanecer el tiempo suficiente en contacto con el espécimen, para que pueda ser absorbido. A continuación, se retira el exceso de colorante, normalmente lavando con agua.
Tipos de colorantes Casi todos los colorantes son sales, compuestos formados por iones cargados. Los colorantes básicos son aquellos en los cuales el agente que tiñe es el ion cargado positivamente, mientras que en los ácidos, el colorante es el ion cargado negativamente. Los colorantes más utilizados son los de tipo básico, va que la mayor parte de las células microbianas Poseen cargas débilmente negativas en su superficie, lo cual facilita su unión. Entre los colorantes básicos más comunes se encuentran la safranina, la fucsina básica, el cristal violeta y el azul de metileno. Los colorantes ácidos se unen a las partes de las células cargadas positivamente. Se utilizan para teñir tejidos animales infectados con microorganismos. Entre los más frecuentes están la eosina, la fucsina ácida y el rojo Congo.
| TABLA 3.2 Técnicas de tinción para bacterias | ||
| Tinción | Uso | Técnicas |
|---|---|---|
| Tinciones simples | Un colorante; proporciona contraste para observar mejor un organismo completo | Se tine con un colorante básico (azul de metileno, cristal violeta, o fucsina básica) durante unos 5 minutos. Aclarar brevemente con agua. Se tiñen casi todas las bacterias; la rnayoría de los tejidos no se tiñen. |
| Tínciones diferenciales | ||
| Tinción de Gram | Dos o más colorantes; distingue entre bacterias Gram positivas y Gram negativas | Se cubre la preparación de bacterias fijadas con cristal violeta y después
con una solución de iodo (mordiente). Todas las células quedan tenidas
de color violeta oscuro. Se decolora con acetona al 95%. Las células Gram positivas permanecen tenidas, pero las negativas pierden el colorante. Se tiñe con safranina (contraste). El color violeta de las Gram positivas se vuelve más oscuro y las Gram negativas se tiñen de rosa. |
| Tinción de ácido-alcohol resistencia (Ziehl-Neelsen) | Dos colorantes; distingue entre las micobacterias (ácido-alcohol resistentes) y el resto de las bacterias | Se tiñen las células con fucsina básica y se calienta a emisión de vapores durante 5 minutos. Todas las bacterias se tinen de rojo. Se decolora brevemente con una mezcla de alcohol-HCl. Las bacterias resistentes permanecen teñidas de rojo; todas las demás se decoloran. Se trata con el colorante de contraste azul de metileno. Las bacterias ácido-alcohol resistentes continúan tenidas de rojo, las otras se tiñen de azul. |
| Tinciones especificas | ||
| Tinción de esporas de Wirtz-Cortitlin | Tiñe selectivamente las endosporas | Se cubre la preparación con verde de malaquita y se calienta a emisión de vapores durante 60 segundos. Se lava con agua durante 30 segundos y se tiñe con safranina. Las endosporas retienen el color verde; el resto de la célula toma el color rosa. |
| Tinción de flagelos de Leifson | Permite observar los flagelos | A las células previamente fijadas, se le añade una mezcla de ácido tánico (mordiente) y del colorante rosanilina. El mordiente engruesa los flagelos y el colorante los fine. |
| Tinción negativa | Revela la presencia de cápsulas | Se utiliza tinta china o nigrosina para tenir una preparación en fresco del espécimen. Las particulas de colorante no pueden penetrar en la cápsula, que se observa como una región clara alrededor de la célula. |