Los mordientes, aunque no son colorantes, tienen gran importancia en algunas técnicas de tinción. Los mordientes intensifican la tinción porque aumentan la afinidad de la célula por el colorante. También se pueden utilizar para producir un engrosamiento de ciertas estructuras celulares externas, como los flagelos, que debido a su delgadez no podrían ser visualizados de otra forma.
Existen tres tipos de técnicas de tinción: simples, diferenciales y específicas (especiales) (Tabla 3.2).
Tinciones simples En las tinciones simples se usa un único colorante, que siempre es de tipo básico. Se utilizan solamente para incrementar el contraste; todas las células absorberán el colorante y quedarán teñidas del mismo color. Por tanto, la tinción simple mejora la obsenación de la célula completa. Se fija el espécimen, se añade el colorante y se deja el tiempo adecuado para que se absorba, se retira el exceso de colorante y la preparación ya está lista para ser observada. Si se utiliza un mordiente, hay que añadirlo justo antes del colorante.
Tinciones diferenciales Las tinciones diferenciales se utilizan para distinguir entre tipos de microorganismos. La técnica de tinción diferencial consta de dos etapas: una tinción primaria (siguiendo el mismo método que en una tinción simple) seguida de una tinción de contraste. En la tinción de contraste se utiliza otro colorante que tiñe (y por tanto, revela) las células no teñidas por el primer colorante. Estas tinciones son muy utilizadas en microbiología. Por ejemplo, la tinción de Gram y la tinción de ácido-alcohol resistencia, ambas aplicadas a bacterias.
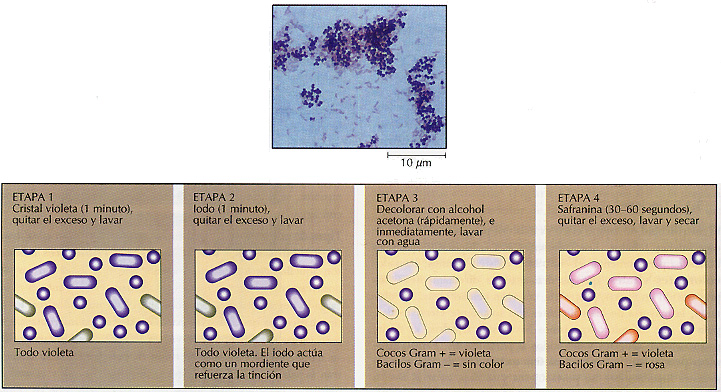
La tinción de Gram La técnica de la tinción de Gram fue desarrollada por el bacteriólogo danés Christian Gram en 1884. Esta tinción clasifica las bacterias en dos grupos: Gram positivas y Gram negativas (Figura 3.9). La técnica incluye tinción primaria, decoloración y tinción de contraste:
1.Se tiñe el espécimen con el primer colorante, cristal violeta, que tiñe de violeta.
2.Se añade el mordiente, iodo.
3.Se aplica el agente decolorante, normalmente una solución de acetona o etanol. En este momento, las bacterias Gram negativas pierden su tinción violeta, pero las Gram positivas retienen el colorante.
4. Como colorante de contraste se añade safranina, que tiñe de rosa las bacterias Gram negativas, previamente decoloradas; mientras que a las bacterias Gram positivas les proporciona un color violeta más intenso.

Figura 3.9 Tinción de Gram. La tinción de Gram divide a las bacterias en dos grupos, Gram positivas y Gram negativas. La microfotografía muestra una preparación teñida por la técnica de Gram y que contiene células de Staphylococcus aureus y de Escherichia coli. Esta última es una bacteria Gram negativa, porque sus células han perdido el color violeta durante la decoloración y se han teñido de rosa con el colorante de contraste.
El distinto comportamiento frente a los colorantes de las bacterias Gram positivas y Gram negativas se debe a las diferencias existentes en sus superficies externas. Las células Gram negativas poseen una capa de peptidoglicano delgada y una membrana ex-terna. Las bacterias Gram positivas poseen una capa gruesa de peptidoglicano v carecen de membrana externa. Esta importante diferencia se describe más adelante en el Capítulo 4.
La tinción de Cram es extraordinariamente útil en clínica. Esta técnica es, casi siempre, la primera prueba que se lleva a cabo en la identificación de un microorganismo causante de una enfermedad, aislado de un paciente. Con sólo un microscopio y unos cuantos botes de colorante podemos averiguar si un organismo es Gram positivo o Gram negativo, su morfología celular y su agrupación típica. Esto, a veces, es suficiente para determinar con qué tipo de bacteria estamos trabajando. Es más, el tratamiento de una inFección depende de que el agente sea Gram positivo o Gram negativo, ya que algunos antibióticos actúan Sólo sobre los primeros, y otros sobre los segundos. La penicilina, por ejemplo, es más efectiva contra bacterias Gram positivas; mientras que la estreptomicina v la tetraciclina actúan sobre ambas.
La tinción de ácido-alcoho] resistencia La tinción diferencial de ácido-alcohol resistencia fue desarrollada por Paul Ehrlich en 1 882. Actualmente se utiliza una modificación de la técnica de Ehrlich que recibe el nombre de tinción de Ziehl-Neelsen. Esta tinción sirve para teñir bacterias del género Mycobacterium, el resto de las bacterias se tiñen de azul por el colorante de contraste. M. tuberculosis, causante de la tuberculosis y M leprae, causante de la lepra o enfermedad de Hansen, se identifican mediante esta tinción (Figura 3.10). Las micobacterias son ácido-alcohol resistentes porque poseen en sus cubiertas lípidos de ácidos grasos complejos que forman en su pared celular un material de tipo céreo resistente a la decoloración (Capítulo 2). Una tinción ácido-alcohol resistente se realiza según los siguientes pasos:
1.Tinción primaria con fucsina básica, que tiñe todas las células de rojo.
2.Calentamiento suave de la preparación para facilitar la penetración del colorante en el interior de la célula.
3. Decoloración con una solución de ácido clorhídrico en etanol. Este decolorante elimina la fucsina de todas las células excepto de las micobacterias, que la retienen debido a su superficie cerea.
4.Coloración de contraste con azul de metileno. Se tiñen de azul todas las células previamente decoloradas, lo que facilita la diferenciación entre las células de Mycobacterum, aún teñidas de rojo, v las células restantes del espécimen.
Tinciones específicas Mientras las tínciones diferenciales permiten distinguir entre distintos tipos de microorganismos, las tinciones específicas incrementan el contraste en las células microbianas y revelan estructuras particulares, entre las que se incluyen las endosporas, los flagelos y las cápsulas.
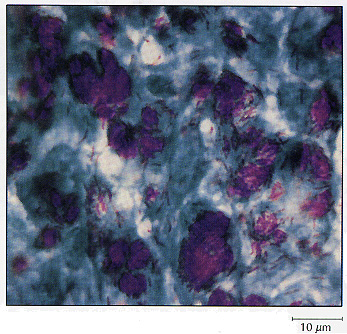
Figura 3.10 La tinción de ácido-alcohol resistencia se utiliza
para identificar a Mycobacterium, ya que esta bacteria posee ceras en su pared
celular que resisten la decoloración. La microfotografía muestra masas
de células de M. leprae en el interior de sus células hospedadoras.
Las mico-bacterias permanecen teñidas de rojo, mientras que el resto de las
bacterias toman el color azul del colorante de contraste.