NOTAS CLíNICAS
En primer lugar haga una tinción de Gram
Un muchacho de diecinueve años que estaba perfectamente por la mañana, comenzó a sentirse mal por la tarde. Sus padres lo encontraron paseandose por la casa en ropa interior, jurando murrnurando entre dientes. Cada vez se encontraba más agitado y hostil. Finalmente, con la ayuda de un vecino, lo metieron a la fluerza en un coche y lo llevaron a urgencias. Aunque su extraño comportamiento podía ser debido a las drogas, tenía una fiebre de 40 0C, lo cual sugería una infección. Se le tornaron muestras de sangre, orina y líquido cerebroespinal (obtenido mediante punción lumbar). En unos minutos el médico de urgendas tuvo el diagnóstico. Una tinción de Gram del líquido cefalorraquideo reveló la presenda de numerosos diplococos Gram negativos (bacterias esféricas en parejas). Se trataba de Neisseria meningitidis, causa común de la meningitis bacteriana en adultos jóvenes (Capítulo 25). El diagnóstico precoz mediante la tinción de Gram, permitió un tratamiento rápido y la completa recuperación de la infección que amenazaba su vida.
La tinción de esporas de Wirtz-Conklin Algunas bacterias poseen endosporas, estructuras de resistencia que les permiten sobrevivir en condiciones ambientales extremas (Capítulo 4). Las endosporas poseen cubiertas gruesas e impermeables que no absorben la mayoría de los colorantes. La tínción de esporas de Wirtz-Conklin, sin embargo, es efectiva:
1.Tinción con verde de malaquita.
2.Calentamiento a emisión de vapores durante tres a seis minutos, para que el colorante penetre a través de las paredes de la endospora.
3.Lavado con agua del grifo, que elimina el colorante verde de todas las partes de la celula, con excepción de las esporas.
4.Tinción de contraste con el colorante rosa safranina.
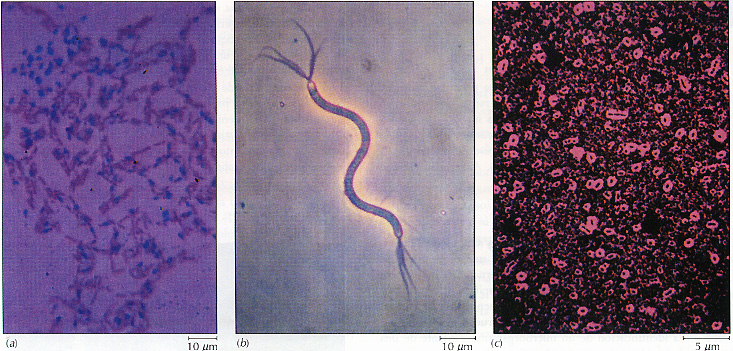
Al final del proceso, las endosporas bacterianas quedan teñidas de verde y el resto de la celula (le rosa (Figura 3.1a). Las bacterias Bacillus anthracis y Clostridium perfringens, agentes etiológicos del carbunco y la gangrena, respectivamente, forman esporas y pueden ser identificadas mediante esta tinción.
La tinción de flagelos de Leifson Los flagelos, largos y finos apéndices de las cúlulas bacterianas que les permiten moverse (Capítulo 4), son tan delgados que resultan invisibles al microscopio óptico, si no se realiza una técnica especial para su tinción. Los distintos métodos de tinción utilizan combinaciones de mordientes y metales para engrosar los flagelos, así como colorantes para teñirlos. La tinción de flagelos de Leifson se realiza según la siguiente técnica:
1.Se fija químicamente la suspensión bacteriana, mediante formol, y se hace la extensión en un portaobjetos.
2.Se deja secar al aire, sin calentamiento alguno.
3.Se cubre la preparación con una mezcla de ácido tánico y el colorante rosanilina, de preparación extemporánea. El ácido tánico engruesa los flagelos y la rosanilina los tiñe.
4.Se retira el exceso de colorante con agua.
5. Por último, se deja secar al aire, antes de su observación al microscopio.

Figura 3.11Tinciones específicas. (a) La tinción de Wirtz-Conklin se utiliza para observar endosporas. Bacilius cereus es una bacteria esporulada. Las endosporas mantienen la tinción primaria verde, mientras que las otras células se observan teñidas con la coloración de contraste rosa. (b) La tinción de Leifson revela que este microorganismo posee flagelos, lo cual contribuye a su identificación como Spirillum volutans..(c) La tinción negativa con tinta china permite observar que esta bacteria posee cápsula, lo que facilita su identiticación como Klebsiella pneumoniae, agente causal de la neumonía.
Esta tinción permite determinar el número y la disposición de los flagelos de las bacterias, lo que constituye una información esencial para la identificación de muchas especies (Figura 3.11b). La tinción de flagelos es un arte que se adquiere sólo con la práctica.
Tinción negatira Algunas bacterias están rodeadas por una estructura protectora denominada cápsula (Capitulo 4). Para poner de manifiesto la presencia de una cápsula se utiliza una técnica denominada tinción negativa:
1.Se hace una preparación en fresco del espécimen.
2.Se añade tinta china. Las partículas de carbón de la tinta no pueden penetrar en la cápsula, de manera que solo se ennegrece el fondo.
3.Al microscopio, se observan las cúlulas y sus capsulas, como zonas claras alrededor de las mismas (Figura 3.1c).
4. Se puede aplicar un colorante para hacer las cúlulas más visibles (los colorantes habituales no tiñen las cápsulas). También se puede usar nigrosina, en lugar de tinta china.


Figura 3.12 Imágenes de Paramecium al mismo aumento (1000x), pero con distintos microscopios. (a) La microscopía de campo claro permite observar la forma y las estructuras internas de mayor tamaño, como el núcleo. (b) La imagen de contraste de fases muestra mayor detalle interno, y el característico halo. (c) La microscopía de campo oscuro revela la presencia de cilios. (d) La imagen de Nomarsky es casi tridimensional.
3.1.6 Microscopia óptica: otras formas de lograr el contraste
El microscopio de campo claro es el más utilizado en los laboratorios de clínica v las tínciones son los mejores métodos para aumentar el contraste en este tipo de microscopio. Pero con los años, se han perfeccionado microscopios ópticos compuestos que son capaces de aumentar el contraste sin necesidad de teñir el espécimen. Estos microscopios son los de contraste de fases, campo oscuro, fluorescencia y Nomarskv.
Microscopia de contraste de fases: El microscopio de contraste de fases proporciona una imagen clara y detallada de células vivas sin teñir. En un microscopio óptico ordinario, el contraste se debe a que los materiales distintos absorben diferentes cantidades de luz. Sin embargo, en el microscopio de contraste de fases se debe a los distintos índices de refracción entre las partes de los microorganismos y el fondo. Las únicas diferencias estructurales entre un microscopio óptico ordinario y uno de contraste de fases son los sistemas de las lentes del objetivo y del condensador, que en el segundo están dotados de unos anillos opacos especiales.
El microscopio de contraste de fases se fundamenta en el hecho conocido de que las ondas de luz viajan a distintas velocidades en los materiales que poseen índices de refracción diferentes. Por tanto, los rayos de luz que pasan a través del espécimen no se encuentran en la misma fase que los que pasan a su alrededor. Imaginemos las olas del océano viniendo hacía la playa desde diferentes direcciones. Las olas se suman o anulan unas a otras, dependiendo de que sus crestas lleguen al mismo tiempo o no. De forma similar, el microscopio de contraste de fases combina los rayos de luz procedentes del espécimen y los que llegan de sus alrededores. Los rayos se suman o se anulan unos a otros produciendo diferentes intensidades de luz y aumentando, en consecuencia, el contraste. Se denomina interferencia al resultado de la combinación de rayos de luz de distinta fase.
La mayor ventaja que ofrece la microscopía de contraste de fases consiste en poder estudiar el movimiento y las estructuras celulares internas, que mediante esta técnica no son distorsionadas por la fijación y tinción. El contraste de fases proporciona considerable detalle interno. Su inconveniente es que la imagen aparece rodeada por un halo de luz, que es una consecuencia inevitable del fenómeno de interferencia, que genera el contraste (Figura 3.12).
Microscopia de campo oscuro: El microscopio de campo oscuro también permite visualizar células vivas sin tenir. Este microscopio se basa en el principio de dispersión (esparcimiento), lo que significa que un rayo de luz cambiará de dirección, se dispersará, cuando choque contra un objeto pequeño. El microscopio de campo oscuro posee un condensador especial con un disco que desvía los rayos de luz para que no penetren en el objetivo: los únicos rayos que llegarán al objetivo son aquellos que hayan sido dispersados al incidir en el espécimen. El resultado es una imagen brillante contra un fondo oscuro (Figura 3.12c). La microscopía de campo oscuro es la mejor para la observacion de estructuras externas, especialmente los flagelos, pero deja ver menos detalles internos que la microscopia de contraste de fases. La técnica de campo oscuro se utiliza para Treponema palladium, una bacteria muy móvil, agente causante de la sífilis (Capítulo 24).
Microscopia de fluorescencia: En la microscopia de fluorescencia el contraste se aumenta por medio de la fluorescencia. Ésta es la propiedad que tienen algunos materiales de absorber luz de una determinada longitud de onda y devolverla con una longitud de onda mavor. Cuando se iluminan materiales fluorescentes con luz ultravioleta de longitud de onda corta (invisible), devuelven luz visible, intensamente brillante contra un fondo oscuro (Figura 3.13). A diferencia de las microscopias de contraste de fases y de campo oscuro, este tipo de microscopia depende de una propiedad del propio espécimen, no del microscopio. Sin embargo, el microscopio debe modificarse con filtros especiales para iluminar la preparación con luz ultravioleta de longitud de onda corta.
Algunos microorganismos, entre los que se incluyen algunas bacterias fotosíntéticas y algas, son fluorescentes por sí mismos pero en la mayor parte de los casos hay que teñir con unos colorantes denominados fluorocromos. Algunos fluorocromos se unen directamente a los microorganismos. Otros han de unirse químicamente a anticuerpos, proteínas producidas por el sistema inmune capaces de unirse a microorganismos específicos (Capitulo 17). Por este motivo, la microscopia de fluorescencia puede utilizarse tanto para identificar como para observar microorganismos. El diagnóstico mediante anticuerpos fluorescentes, o inmunofluorescencia, es una de las aplicaciones mas importante de esta microscopia. Se describirá con detalle en el Capítulo 19.
Microscopia de Nomarsky Se basa en los principios expuestos por Georges X. Nomarskv a finales de los años cincuenta. La microscopia de Nomarsky, o de contraste de interferencia diferencial, se ha usado sólo durante los últimos 20 años. Como la microscopia de contraste de fases, la de Nomarskv utiliza las diferencias en los índices de refracción y produce el contraste por interferencia; pero se diferencian en el sistema mediante el cual se separan los rayos interferentes. La microscopia de contraste (le fases utiliza un par complementario de anillos opacos, uno localizado por debajo del condensador y el otro en la parte posterior de la lente objetivo. El microscopio de Nomarskv utiliza un par de prismas situados en el mismo sitio. Estos sistemas diferentes para dirigir la luz producen distintos tipos de imágenes. La microscopia de Nomarsky produce una imagen casi tridimensional con más detalle que la microscopia de contraste de fases (Figura 3.12d). Se utiliza para visualizar microorganismos vivos en tejidos animales.
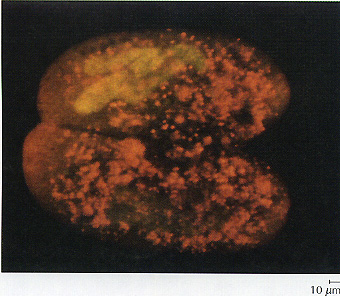
Figura 3.13 Algunos microorganismos son fluorescentes de forma natural, pero la mayoría requieren ser teñidos con compuestos fluorescentes. Cuando se añade un fluorocromo a estas células apareadas de Paramecíum tetrautelia, se observan con fluorescencia naranja.
3.1.7 Microscopía electrónica
Todos los microscopios ópticos modificados que hemos descrito
aumentan el contraste de la imagen. Sin embargo, ninguno de ellos puede incrementar
significativamente el poder de resolución -el grado con que se distinguen
los puntos individuales de un detalle- porque éste depende de la longitud
de onda de la luz utilizada, que en estos casos es siempre luz visible. Por tanto,
el desarrollo de la microscopia electrónica en los años
treinta fue uno de los progresos más grandes dentro de este campo. Los microscopios
electrónicos poseen un poder de resolución muy superior al de los microscopios
ópticos y en consecuencia, producen un mayor aumento útil de
las imágenes. Existen dos tipos de microscopios electrónicos de uso
común, el microscopio electrónico de transmisión (MET) y
el microscopio electrónico de barrido (MEB). El MET tiene
mayor poder de resolución, pero el MEB produce una imagen tridimensional de
gran calidad. 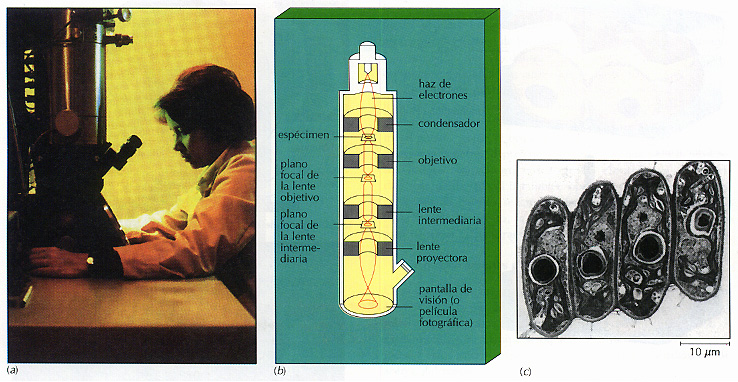
Figura 3.14 El microscopio electrónico de transmisión (MET). (a) El MET es sobre todo una herramienta de investigación, demasiado grande y complicada para el uso rutinario de laboratorio. (b) Utiliza un chorro de electrones y lentes electromagnéticas para crear imágenes de gran resolución y detalle. (c) La microfotografía de transmisión muestra al alga verde Scenedesmus. Comparar esta imagen con la obtenida mediante microscopia electrónica de barrido (MEB) del mismo espécimen (Figura 3.17).
Microscopia electrónica de transmisión El microscopio electrónico de transmisión (MET) tiene mayor poder de resolución que el microscopio óptico, porque utiliza un chorro de electrones para definir el objeto, en logar de luz visible (Figura 3.14). El MET aprovecha el hecho de que el haz de electrones se comporta como una radiación electromagnética con una longitud de onda extraordinariamente corta. Un microscopio electrónico de transmisión puede distinguir dos puntos separados por una distancia de 1 mm -200 mm sería la distancia mínima para un microscopio óptico. Este tipo de microscopia produce una imagen detallada y nítida a aumentos de hasta 200000x, en comparacion con los l000x del microscopio óptico.
En muchos aspectos el MET funciona como un microscopio óptico. En lugar de un haz de luz, se transmite un haz de electrones a través del espécimen. En vez de lentes de cristal, se utilizan lentes electromagnéticas para enfocar la imagen. En lugar de producir la imagen directamente, ésta se registra en una pantalla fluorescente o en una placa fotográfica (a la imagen se le denomina microfotografia electrónica de transmisión). En vez de montar el espécimen en un portaobjetos, se prepara en una rejilla de cobre que permite el paso de los electrones. En lugar de usar colorantes para aumentar el contraste, se utilizan metales pesados, como el plomo, tungsteno y uranio, que hacen que el espécimen absorba diferentes cantidades de electrones.
En otros aspectos, el MET presenta problemas técnicos especiales. La principal dificultad es que los electrones tienen un poder de penetración muy pequeño. Como resultado, si se desea ver un detalle intracelular es preciso realizar secciones finas del microorganismo. Mediante un instrumento denominado microtomo, el espécimen se corta en delgadas secciones con un grosor no superior a 0,1 µm.
En lugar de secciones finas, también se puede preparar el espécimen
mediante otras técnicas denominadas criofractura y criograbado (Figura
3.15). Estos métodos resultan especialmente adecuados para examinar membranas
intracelulares. El espécimen se congela en un bloque de hielo, que posteriormente
se rompe con una cuchilla. La fractura se extiende a través de orgánulos
y membranas dejando al descubierto estructuras internas. Los detalles de la estructura
pueden mejorarse por criograbado; la muestra fracturada se deseca al vacío
(proceso denominado sublimación); esto hace que las estructuras queden en
relieve sobre la superficie. A continuación se pulveriza carbón sobre
el especimen, que aún esta congelado, y se obtiene una replica, que
se utiliza para su observación al MET.