
A menudo se incrementa el contraste por sombreado metálico, que consiste en recubrir el espécimen con una fina capa de un metal pesado, como oro o platino, depositado desde un ángulo (Figura 3.16). Los objetos de la preparación producen "sombras" en la capa de metal, dando lugar a una imagen con apariencia tridimensional que revela la forma y, después de unos cálculos, el tamaño.

Figura 3.15 Criofractura y criograbado. La microscopia electrónica de transmisión requiere una preparación especial de las muestras, debido a que los electrones tienen poco poder de penetración. Se pueden hacer secciones finas de las células o se puede seguir las técnicas de criofractura y criograhado. (a) En la criofractura, las células se congelan en un bloque de hielo que a continuación se rompe con una cuchilla. (b) Para más detalles se puede seguir la técnica de criograbado: las células se someten a vacío y se elimina el agua por sublimación. Esto hace que las estructuras sobresalgan en la superficie. (c) Microfotografía de una levadura tratarla mediante estas técnicas la levadura está gemando.

Figura 3.16 Sombreado metálico. La principal ventaja de la microscopía electrónica de transmisión es su poder de aumento, que permite ver virus y la ultraestructura (estructura interna) de las células. Si el espécimen se prepara por sombreado metálico, la MET también puede utilizarse para observar estructuras externas. (a) Se recubre la muestra con una capa de metal pesado, que le da aspecto tridimensional. (b) Microfotografía de transmisión del virus de la polio preparado mediante sombreado metálico; se observan las tres dimensiones: longitud, anchura y espesor.
Después de llevar a cabo estas laboriosas tecnicas, las preparaciones han de observarse al vacío, para que el aire no interfiera la transmisión del chorro de electrones. Esto significa que la muestra debe ser desecada completamente. Esta elaborada preparación y desecación de las muestras, a menudo, introduce artefactos, que son estructuras o detalles que aparecen en la imagen pero que no existen en el especimen. Por ejemplo, durante bastante tiempo se creyó que las bacterias tenían unas estructuras invaginadas en la membrana llamadas mesosomas. Hoy sabemos que estas invaginaciones son artefactos, que se producen durante la preparación de las muestras para microscopio electrónico. Se requiere una considerable experiencia para interpretar las microfotografías electrónicas.
Microscopia electrónica de barrido El microscopio electrónico de barrido (MEB) se parece al de transmisión en que utiliza electrones, pero en la mayor parte de sus otros aspectos es diferente (Figura 3.17). Todos los microscopios descritos hasta ahora (con excepción del de campo oscuro) se basan en el paso de la luz o de los electrones a través del especimen. Pero el MEB bombardea la superficie de la preparación con un chorro de electrones. Estos electrones "primarios" expulsan electrones "secundarios" del espécimen. El número de electrones expulsados varía con la composición y conformación de las diferentes partes de la superficie. Los electrones secundarios se recogen para generar una señal que es procesada electrónicamente. La señal procesada produce una imagen de la superficie en un tubo de ravos catódicos (como el tubo de un televisor). Debido a que solamente "ve" la superficie del objeto, el MEB tiene una gran profundidad de foco y produce imágenes tridimensionales sorprendentes. El microscopio electrónico de barrido puede distinguir objetos situados a menos de 20 nm uno del otro, y por tanto proporciona detalles claramente definidos con aumentos de hasta 10000X.
Este tipo de microscopia se utiliza, normalmente, con células intactas. Los especímenes son liofilizados (congelados y desecados al vacío) y a continuación se cubren con una capa fina de un metal pesado, como el oro o el platino. Esto último evita que los electrones penetren dentro del espécimen, lo que permite obtener una imagen (llamada microfotografia electrónica de barrido) más nítida. El MEB también opera al vacío. Aunque el microscopio de barrido se emplea, normalmente para describir la superficie de un objeto, la técnica de criofractura permite su uso para visualizar estructuras del interior de las células (Figura 3.15).
3.1.8 Aplicaciones de la microscopia
Cada uno de los microscopios descritos tiene sus ventajas e inconvenientes y, por tanto, diferentes aplicaciones. En general, los microscopios ópticos son los de uso cotidiano. La preparación de especimenes y su manipulación son relativamente sencillas y rápidas y estos microscopios proporcionan una información valiosa acerca del tamaño, forma y apariencia general de las células. Sin embargo, la resolución es limitada y, por tanto, su poder de aumento también.
La microscopia electrónica es principalmente una herramienta de investigación. Estos aparatos son grandes y complejos, debido a las necesidades que plantea el trabajar con electrones maxime si se les compara con los simples y compactos microscopios ópticos. Sin embargo, los microscopios electrónicos nos permiten ver los detalles de las células, lo que llamamos ultraestructura, y tienen el suficiente poder de resolución y aumento para observar virus y objetos aún más pequeños, como las moleculas grandes. En la Tabla 3.3. se resumen los tipos de microscopios que hemos descrito y sus características.
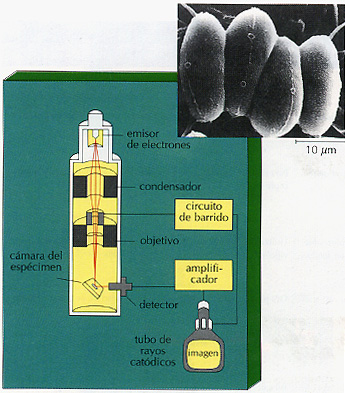
Figura 3.17 La microscopia electrónica de barrido (MEB) utiliza un haz de electrones para barrer el espécimen y producir la salida de electrones secundarios, que son los que crean la imagen. Esta microscopia no está basada en la transmisión de luz o electrones a través del espécimen. La MEB produce imágenes de superficies, por tanto de calidad tridimensional, como esta imagen de Scenedesmus.
3.2 CULTIVO DF LOS MICROORGANISMOS
En muchos aspectos, el pequeño tamaño de los microorganismos los hace sujetos ideales para la experimentación. Se pueden cultivar millones de organismos en un solo mililitro de medio para su estudio. La rápida multiplicación de estas diminutas criaturas constituve también una ventaja experimental, ya que se puede trabajar con muchas generaciones en un solo día, Es más, los conocimientos adquiridos en el estudio de los microorganismos pueden ser, a menudo, generalizados a los sistemas celulares, plantas y animales, incluida la especie humana. Para llevar a cabo experimentos con microorganismos es usualmente necesario cuítivarlos en el laboratorio.
3.2.1 Obtención de un cultivo puro o axénico
Un cultivo axénico consiste en una sola especie microbiana, proveniente de una sola célula. Los cultivos axénicos son muv raros en la naturaleza. En los medios naturales -por ejemplo, en el suelo, agua, o en el cuerpo humano- existen cultivos mixtos. En un cultivo mixto, viven muchas y diferentes especies de forma conjunta. Un cultivo axénico se obtiene artificialmente en el laboratorio.
En lo que resta de este capítulo, estudiaremos los métodos para obtener y propagar los cultivos axénicos. Estos métodos se desarrollan para bacterias y hongos, pero con unas pequeñas modificaciones, también pueden ser aplicados a algas y protozoos. Los métodos para obtener cultivos axénicos de virus se describirán en el Capítulo 13.
La obtención de un cultivo axénico es un proceso de dos etapas. Primero, hay que esterilizar todos los materiales para eliminar todos los microorganismos presentes en ellos. Segundo, hay que aislar y cultivar un solo microorganismo, para producir un clon de descendientes.
3.2.2 La esterilización
A la hora de obtener un cultivo axénico se han de tomar precauciones especiales, ya que los microorganismos están por todas partes, en la naturaleza, en el laboratorio y en los instrumentos y recipientes usados en los experimentos. Estos microorganismos no deseados o contaminantes deben ser eliminados de un cultivo para que éste pueda ser axénico.
La eliminación de todos los microorganismos se denomina esterilización. Los fundamentos de la esterilización y su aplicación en medicina clínica y en la industria se estudiarán en el Capítulo 9. En este capítulo describiremos solamente su relación con el cultivo de los microorganismos en el laboratorio.
Todos los aparatos y todo el material utilizado para obtener un cultivo axénico ha de esterilizarse. Esto incluye el medio, las sustancias líquidas o sólidas que se añadan como nutrientes al cultivo, los matraces, tubos de ensayo, las placas, los utensilios necesarios para transferir los cultivos de un recipiente a otro (pipetas, jeringas), etc. Como medios usuales de esterilización en el laboratorio se utilizan el calor, la filtración y los compuestos químicos.
TABLA 3.3. Los usos de los microscopios |
|||
| Tipos de microscopía | Características clave | Aspecto de la imagen | Principales aplicaciones |
| Microscopia óptica | |||
| Campo claro | El contraste se logra por absorción. | Imagen clara. | Las muestras requieren tinción. Para observar organismos completos. |
| Contraste de fases | El contraste se consigue por interferencia; las diferencias en el indice de refracción cambian la fase de la luz | Imágenes claras y detalladas rodeadas de un balo. | No requiere tinción; se pueden observar preparaciones en fresco de células vivas. |
| Campo oscuro | Solamente la luz dispersada por la muestra entra en el objetivo, produciéndose un contraste elevado. | Imagen brillante contra un fondo oscuro. | Para observar células vivas o flagelos demasiado finos para la microscopia de contraste de fases; pocos detalles internos. |
| Fluorescencia | Se basa en la capacidad de emitir luz visible que tienen los especimenes fluorescentes cuando se les ilumina con luz ultravioleta | Especimenes muy coloreados (luminosos) contra un fondo oscuro. | Utilizando anticuerpos fluorescentes se pueden identificar tipos especificos de microorganismos presentes en una mezcla compleja. |
| Nomarsky | Tiene el mismo flindamento que la microscopia de contraste de fases, pero utiliza un prisma (en vez de un anillo) para separar el rayo interferente. | Produce una imagen casi tridimensional. | Útil para observar organismos vivos en el interior de tejidos animales. |
| Microscopía electrónica | |||
| Transmisión (MET) | Hace pasar un haz de electrones a través de la preparación, produciendo un gran aumento útil | Imágenes muy ampliadas con gran detalle. | Para observar virus y la ultraestructura celular. No se pueden observar organismos vivos porque las preparaciones ban de ser totalmente desecadas. Puede producir artefactos. |
| Barrido (MEB) | Barre los especimenes con un chorro de electrones, produciendo la salida de electrones secundarios que crean una señal, que, a su vez, genera una imagen por ordenador. | Imagen tridimensional. | Para ver estructuras de organismos intactos, e incluso estructuras internas con detalles reales. Las muestras han de ser desecadas, por tanto, no se puede aplicar a organismos vivos |
Esterilización por calorEl calor es el método de elección para esterilizar el material de laboratorio resistente a las altas temperaturas. La temperatura y el tiempo requeridos para esterilizar un material depende de que se esté utilizando calor seco o calor húmedo.
El calor húmedo mata los microorganismos más rápidamente que el calor seco. Cuando se utiliza calor húmedo, una temperatura de 121 oC durante 20 minutos proporciona condiciones fiables para esterilizar la mayor parte del material de laboratorio. El material voluminoso o los grandes volúmenes de líquido requieren un tiempo mayor para que la temperatura letal alcance el centro de los mismos. Por ejemplo, se tarda sólo 15 minutos en esterilizar 10 ml de líquido en un tubo de ensayo, pero aproximadamente una hora y l0 minutos en esterilizar un matraz de 10 litros de capacidad que esté lleno en sus dos terceras partes con líquido. Los objetos no pueden esterilizarse hirviéndolos en contenedores ahiertos, porque la esterilización requiere una temperatura superior a la de ebullición del agua (100 oC, al nivel del mar). Por este motivo, la esterilización por calor húmedo se realiza en camaras presurizadas. A una presión de 1 atmósfera, se puede calentar el agua a 121oC, sin que llegue a hervir. Cuando la cámara alcanza esta temperatura y presión, su con tenido puede ser esterilizado en 20 minutos, a condición de que todo el aire de la misma haya sido reemplazado por vapor de agua.
La cámara presurizada utilizada normalmente en el laboratorio es el autoclave (Figura 3.18). En muchos aspectos una autoclave se parece a una olla de presión casera. De hecho, en algunos pequeños laboratorios de microbiología se utilizan estas ollas en lugar de autoclaves. Ambos son recipientes de metal con paredes suficientemente fuertes para resistir la presión de vapor.
Las autoclaves son grandes cámaras de acero inoxidable que funcionan automáticamente. Los objetos deben ser colocados de manera que el vapor de agua entre en contacto con todas las partes de cada uno de ellos, y el aire no quede atrapado en su interior. El aire que no es reemplazado por vapor crea una bolsa seca, donde la esterilización no será efectiva.
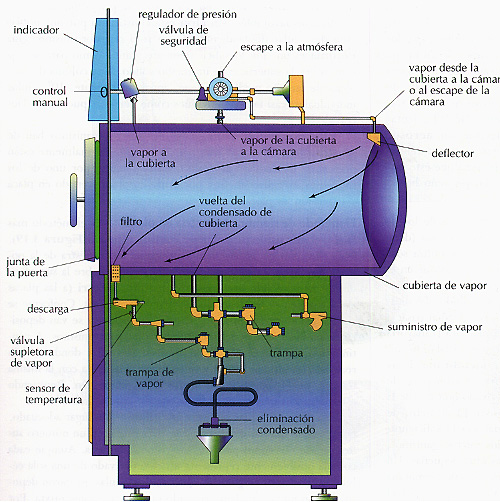
Figura 3.18 Una autoclave utiliza vapor de agua a presión para esterilizar objetos mediante calor. La mayoría de los autoclaves están diseñadas de manera que el mismo vapor hace salir el aire de la cámara. En caso contrario, los objetos que quedaran en las bolsas de aire no se esterilizarían. También están equipados con indicadores que comprueban que se alcanza la temperatura precisa y se mantiene durante el tiempo necesario para la esterilización.
Los medios de cultivo y los materiales textiles, tales como toallas y batas de laboratorio, se esterilizan en la autoclave. También otros materiales secos que resisten las temperaturas altas, incluyendo pipetas de vidrio, matraces vacíos o tubos de ensayo, especialmente si la autoclave posee secado automático. Los materiales que se esterilizan en la autoclave quedan húmedos. El cristal y los instrumentos de metal también se pueden esterilizar por calor seco. Se colocan en hornos de aire caliente y se calientan a 170 oC durante 90 minutos. Las prendas textiles no pueden esterilizarse mediante esta técnica debido a que la elevada temperatura las carbonizana.