La llama de un mechero también se utiliza para esterilizar. Cada vez que
un matraz o un tubo de ensayo se abre para añadir o sacar material, se pasa
la boca del mismo a través de la llama de un mechero, a fin de destruir cualquier
microorganismo que pueda haberse depositado allí. Este procedimiento disminuve
la probabilidad de que las celulas microbianas caigan en el recipiente y contaminen
su contenido. Las asas e hilos de siembra, que los microbiólogos utilizan
para tomar microorganismos de un medio y llevarlos a otro, también se esterilizan
flameándolos en la llama de un mechero Bunsen hasta la incandescencia. Este
metodo de esterilización es rápido y cómodo, pero peligroso
cuando se trabaja con microorganismos causantes de enfermedad. El calentamiento repentino
en una llama puede formar un aerosol (suspensión de pequeñas gotas
de liquido) que contenga celulas microbianas y que puede ser inhalado por la persona
que esté trabajando en el laboratorio. La utilización de un pequeño
horno para esterilizar las asas evita este riesgo.
Filtración Las células microbianas pueden retirarse de los líquidos
o gases por filtración. La filtración es lenta y cara (debe usarse
un filtro nuevo cada vez); por esta razón, se utiliza sólo para los
líquidos termolábiles, que no se pueden esterilizar en el autoclave.
Los sólidos termolábiles también se pueden esterilizar por filtración,
si previamente se disuelven en unl íquido. Tecnicamente, la filtración
no esteriliza porque los virus pueden pasar a través de los filtros, pero
el proceso es suficiente para la mayoría de los estudios de rutina que se
llevan a cabo en el laboratorio. Los filtros utilizados se denominan filtros de
membrana. Estas membranas están compuestas de nitrocelulosa, con un poro
de diámetro constante. La nitrocelulosa es un derivado químico de la
celulosa, que tambien se utiliza como explosivo. El diámetro de poro es aproximadamente
0,45 µm; este tamaño es lo suficientemente pequeño como para
eliminar todos los microorganismos, con excepción de los virus y algunas bacterias
muy pequeñas. Un líquido se filtra haciéndolo pasar a través
de un filtro de membrana acoplado a un matraz especial. Para hacer pasar el líquido
por el filtro se utiliza una bomba de vacío; los microorganismos quedan en
la superficie de la membrana. La filtración es el método de elección
para esterilizar soluciones de vitaminas, antibióticos v otros compuestos
termolábiles, que son añadidos a los medios.
Compuestos químicos La mayoría de los compuestos químicos no se pueden utilizar para esterilizar medios de cultivo, pues permanecen en ellos y son tóxicos para los microorganismos que luego se han de cultivar. sin embargo, son de uso común una vez que el experimento ha finalizado. El hipoclorito sódico (lejía doméstica) se utiliza para destruir los cultivos de la mavoria de los microorganismos patógenos, para que no contaminen el medio ambiente. También se utiliza para esterilizar la superficie de ciertos materiales biológicos, como las semillas y los tejidos vegetales. Los compuestos químicos también se usan para desinfectar los laboratorios. Por ejemplo, las sales de amonio cuaternario se utilizan en la desinfección de mesas, bancos, etc. En las grandes instituciones se usa el gas tóxico óxido de etileno para esterilizar materiales termolábiles, tales como ropas y contenedores de plástico. Este gas se aplica en camaras presurizadas especiales, parecidas a la autoclave.
3.2.3 El aislamiento
El segundo paso para obtener un cultivo axénico es inocular o introducir, una sola célula de un microorganismo en un medio solido o liquido, esterilizado previamente. De esta manera, aislamos un solo microorganismo del resto y se podrá multiplicar en condiciones favorables. Un clon está constituido por una población de células descendientes de un solo microorganismo. Una colonia es un clon lo suficientemente grande como para ser visible sobre la superficie de un medio sólido. Una colonia de bacterias de tamaño medio contiene, aproximadamente, 109 células individuales, casi tantos individuos como personas pueblan la Tierra.
Para aislar células individuales, los microorganismos han de ser diluidos, debido al gran numero en que normalmente están presentes. La dilución se realiza, normalmente, por uno de los siguientes sistemas: siembra por estría en placa, vertido en placa y extensión en placa.
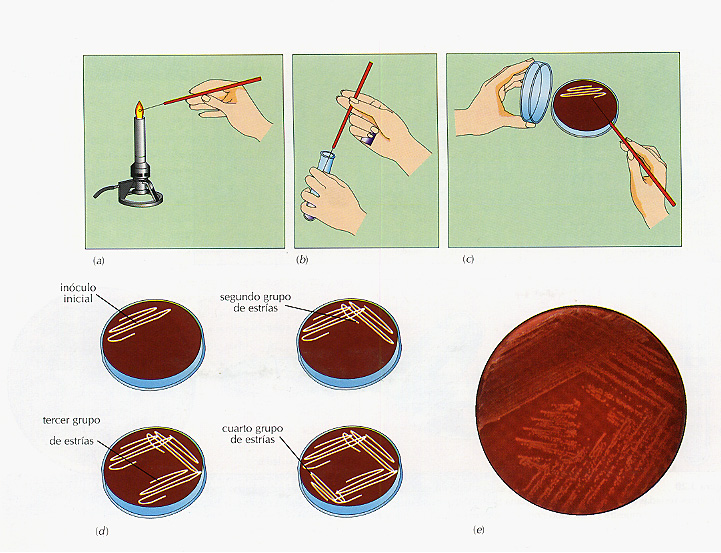
El método de siembra por estría en placa Es el método más fácil y el más usado para obtener cultivos axénicos (Figura 3.19). Para ello, con un asa de siembra se toma una muestra de la población mixta y a continuación se hacen estrías sobre la superficie de un medio sólido preparado en una placa Petrí (a las placas Petri también se les denomina simplemente placas). Conforme se van haciendo estrías en zigzag con el asa, cada vez se van depositando en la superficie del medio menos microorganismos. A continuación, se fiamea el asa, se toca en la región donde se han realizado las últimas estrías y se continúa la siembra con la misma técnica, en la superficie de medio sin sembrar aún. Repitiendo este proceso varias veces se logra separar células individuales.
A continuación, las placas se incuban en un lugar adecuado, permitiendo que las células aisladas experimenten un número suficiente de divisiones para formar colonias visibles. Aunque cada colonia posiblemente representa un clon derivado de una sola célula, no podemos asegurarlo. Quizás, dos células quedaron depositadas tan juntas que han originado una única colonia mixta. Por tanto, para asegurarnos de que hemos obtenido un cultivo axénico, conviene repetir el procedimiento a partir de una colonia bien aislada en la primera placa. La colonias que se desarrollen la segunda vez, serán, casi con toda seguridad, cultivos axenicos.
Los métodos de vertido en placa y extensión en placa En estos métodos, las suspensiones de células microbianas se diluyen antes de su siembra en placa. Se siguen estas técnicas cuando la muestra contiene tantos microorganismos, que la dilución no se puede realizar en una sola etapa. Por ejemplo, una suspensión con mil millones de células por mililitro debe ser diluida 107 veces para obtener una suspensión con un centenar de células por mililitro, Por tanto, se realizan diluciones seriadas (en varias etapas), normalmente de diez en diez, pero a veces de cien en cien (Figura 3.20). Para realizar diluciones de diez en diez, se añade 1 ml de la suspensión bacteriana a 9 ml (le medio estéril o solución salina, igualmente estéril. Se agita vigorosamente para diluir las células y el proceso se repite cuantas veces sea necesario. A continuación, se puede proceder de dos maneras diferentes.
En el método de vertido en placa, las muestras diluidas se mezclan con agar fundido y se vierten en placa. Algunas colonias quedarán embebidas en el agar y otras creceran en la superficie. Las colonias superficiales se extenderán y serán más grandes. En el segundo método (extensión en placa), las muestras diluidas se siembran directamente en la superficie de la placa de agar, extendiéndolas con avuda de un asa de Diralsky de cristal estéril. La suspensión se absorbe en el agar, dejando las células microbianas sobre la superficie. En ambas técnicas las placas se incuban hasta la aparición de las colonias. Como en el método de siembra por estría, no existe la seguridad de que las colonias que aparecen en las placas sembradas por extensión o en el agar solidificado sembrado por el método del vertido en placas sean cultivos axénicos hasta que se repita el proceso.
Las dos técnicas de siembra por dilución presentan la ventaja de que permiten obtener un mayor numero de colonias aisladas que el método de siembra por estría, por tanto se eligen cuando se ha de seleccionar una cepa a partir de una mezcla con varios tipos de microorganismos.

Figura 3.19 Método de aislamiento por siembra por estría en placa. Para obtener un cultivo axénico: (a) esterilizar un asa de siembra por flameado en la llama de un mechero, (b) introducirla en la suspensión bacteriana para recoger una muestra, (c) sembrar haciendo estrías sobre la superficie de un medio sólido en una placa Petri, y (d) volver a esterilizar el asa, tocar en la zona de la placa ya sembrada y hacer un segundo grupo de estrías en una región nueva de la placa. Repetir el proceso una tercera y una cuarta vez, hasta conseguir que los grupos de células se diluyan y se separen células aisladas. (e) Después de la incubación, se desarrollan colonias aisladas. Para estar seguro de que el cultivo es puro, repetir el proceso entero; para ello tomar una colonia aislada y sembrar por estrías una segunda placa.
3.2.4 El crecimiento de los cultivos axénicos
Una vez que se obtiene un cultivo puro, normalmente se ha de propagar (se le hace crecer de nuevo). Seguramente, el investigador deseará obtener más células para poder trabajar con ellas. Para cultivar microorganismos en el laboratorio, se ha de preparar un medio de cultivo, líquido o sólido, con todos los nutrientes necesarios para su crecimiento. Los medios sólidos se hacen generalmente, añadiendo agar a los líquidos (ver cl recuadro "La despensa de Frau Hesse" en el Capítulo 1, para recordar las propiedades especiales del agar).
Tipos de medios de cultivo El tipo de medio que utiliza un microbiólogo depende del microorganismo que está cultivando y el porqué de dicho cultivo. Los microorganismos presentan una enorme variedad de requerimientos nutricionales. Se utiliza un medio mínimo para determinar los requerimientos nutricionales de un organismo y un medio rico si se desea obtener masa celular de una forma rápida. Los medios se pueden formular para el desarrollo de una especie o para distinguir entre especies o cepas. Por tanto, los medios se clasifican en definidos, complejos o indefinidos, selectivos, diferenciales, selectivos-diferenciales y de enriquecimiento, dependiendo de su composición y uso.
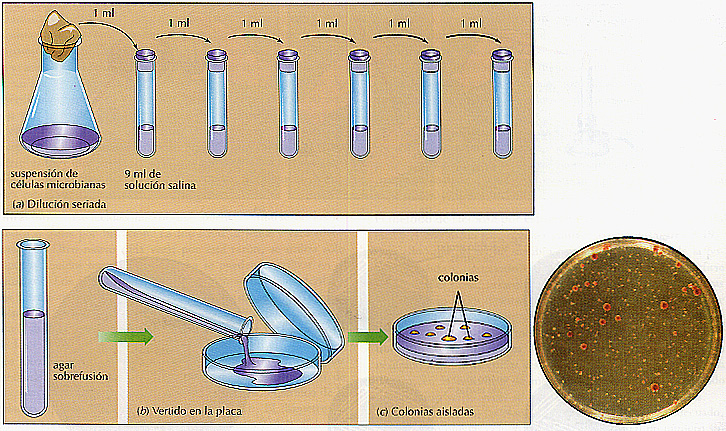
Figura 3.20 Método de vertido en placa. Para obtener un cultivo axénico mediante este método, (a) hacer diluciones seriadas de la suspensión bacteriana hasta obtener una muestra con sólo unos pocos cientos de bacterias, (b) verter la muestra en un tubo con agar a sobrefusión, mezclar y verter el contenido en una placa Petri. (c) Después de la incubación, se desarrollan colonias en el agar (más pequeñas) y en su superficie (más grandes).
Medios definidos Un medio definido es aquel del cual conocemos su composición química exacta, porque ha sido preparado a partir de compuestos químicos puros. Echerichia coli es capaz de crecer en un medio químicamente definido, de composición bastante sencilla (Tabla 3.4). Este microorganismo requiere una fuente de carbono orgánica (por ejemplo, glucosa), pero puede obtener el resto de los nutrientes esenciales a partir de sales minerales. En cambio, otros organismos, denominados exigentes, requieren medios químicamente muy complejos. Por ejemplo, la bacteria Leuconostoc citrovorum es extraordinariamente exigente ya que requiere un medio con muchos ingredientes (Tabla 3.5). Los medios definidos se usan generalmente para realizar estudios genéticos, pero sus inconvenientes a menudo sobrepasan sus ventajas. Así, se requiere un tiempo considerable para preparar un medio definido y las bacterias crecen más despacio en ellos. Además, no conocemos los requerimientos nutricionales de todas las bacterias y, por tanto, no siempre pueden utilizarse.
Medios complejos Se desconoce la composición química
exacta de un medio complejo. Estos medios se preparan a partir de extractos de productos
naturales tales como carne, sangre, caseína (la proteína de la leche),
levaduras o soja. Un medio líquido complejo se denomina caldo. La caseína
u otras proteínas que se añaden a los medios son usualmente hidrolizadas
con enzimas o en medio ácido, para hacerlas más solubles y, por tanto,
más fáciles de utilizar nutricionalmente. Una hidrólisis parcial
rompe las proteínas en péptidos (Capítulo 2). Una hidrólisis
total las degrada hasta aminoácidos. A las proteínas parcialmente hidrolizadas
se les denomina peptonas. Entre las peptonas comerciales se encuentra la proteosa-peptona,
la triptona y la triptosa. A la caseína totalmente hidrolizada se le denomina
hidrolizado de caseina.
Los diversos componentes de un medio complejo se venden como polvos deshidratados. También existen ya cientos de mezclas complejas que se comercializan como medios complejos específicos. Uno de estos medios es el caldo nutritivo, probablemente el medio complejo que más se utiliza (Tabla 3.6). Cuando este medio se solidifica con agar, se denomina agar nutritivo. Generalmente se prefiere la utilizacion de los medios complejos, ya que son fáciles de preparar y permiten un crecimiento rápido de los microorganismos.
LA IMPORTANCIA DE SER PURO
Todos los microbiólogos saben que han de trabajar con cultivos axénicos (puros) para que sus experimentos sean significativos. Pero incluso los microbiólogos más experimentados han cometido errores alguna vez. Esto le sucedió a Ralph Wolfe, uno de los microbiólogos americanos más distinguidos.
En 1960 Wolfe obtuvo un cultivo puro de la bacteria Methanobacillus omelianskii. Este microorganismo es anaerobio estricto, capaz de producir metano (gas natural). Wolfe quería conocer de qué manera M. omelianskií producía gas metano a partir de etanol y anhídrido carbónico. El procedimiento estaba claro; tenía que lisar la bacteria y aislar las enzimas que catalizan la reacción, en un tubo de ensayo. Esto, aunque suena bastante simple, había sido intentado previamente por otros investigadores y todos habían fracasado. Wolfe lo intentó durante todo un año y tampoco tuvo éxito. De repente lo consiguió: una solución de enzima. sintetizaba metano en un tubo de ensayo! Se trataba de un descubrimiento espectacular, hasta que un colega se preguntó si el cultivo era axénico.
Wolfe decidió volver a aislar el culfivo, pero en vez de añadir etanol y anhídrido carbónico al mismo, añadió hidrógeno y anhídrido carbónico. En el nuevo medio se desarrollaron colonias, pero cuando se transfirieron al medio con etanol y anhídrido carbónico no crecieron. ¿Qué había sucedido? Un colega, M.J. Wolin, se dio cuenta de lo que estaba sucediendo. Aunque M. omelianskii originaba colonias uniformes y aisladas en el medio original, se trataba de una mezcla de dos bacterias. Una, designada cepa S, convertía el etanol en hidrógeno gas. La otra, designada cepa M, convertía el hidrógeno gas y el anhídrido carbónico en metano. Ninguna de las dos podía crecer sola con etanol y anhídrido carbónico. Todos los experimentos de Wolfe se habían realizado con un cultivo mixto y tuvieron que repetirse para averiguar qué enzimas pertenecían a la cepa S y cuáles a la cepa M.
¿Qué lección puede aprenderse de la historia de Wolfe? Primero, que los problemas técnicos (tales como obtener un cultivo axénico), aunque son tan básicos que se explican en los textos introductorios, son reales e importunan a los más prestigiosos investigadores. Segundo, que incluso un buen microbiólogo puede equivocarse. Algunas especies pueden crecer juntas (para formar un consorcio) y parecer un cultivo axénico cuando realmente no lo son.
Medios selectivos Un medio selectivo favorece el crecímiento de ciertos microorganismos, mientras suprime el crecimiento de otros. Los medios selectivos se utilizan para aislar especies particulares a partir de una mezcla compleja. Por ejemplo, se utiliza un medio selectivo, para aislar Salmonella typhi, agente causal de la fiebre tifoidea, a partir de heces donde existen cientos de microorganismos diferentes. Algunos medios son selectivos porque contienen un producto químico, como la azida sódíca, el telurito potásico o el cristal violeta, que inhiben el desarrollo de algunos microorganismos pero no de otros. El agar SPS (denominado de esta forma porque contiene sulfadiacina y sulfato de polimixina) se utiliza para identificar Clostridium botulinum, agente causal de una grave intoxicación alimentaria. El medio SPS permite el crecimiento de esta bacteria, pero inhibe el de otras especies de Clostridium. otros medios de cultivo selectivos utilizan un valor extremo de pH o una fuente de carbono poco comun.
Medios diferenciales Se utiliza un medio diferencial para identificar
las colonias de un determinado mieroorganismo. Por ejemplo, para identificar Streptococcus
pyogenes, la bacteria que causa la escarlatina (Capítulo 22), se utiliza
el medio de agar sangre es un agar que contiene hematíes. Las colonias de
esta bacteria muestran a su alrededor una zona transparente debido a que producen
hemolisis (muerte y lisis de los hematíes) (Figura 3.21). Escherichia
coli y las bacterias relacionadas con ella se identifican en medios con
un indicador de pH porque originan productos metabólicos ácidos, que
cambian el color del indicador y por tanto de sus colonias.
| Tabla 3.4 Ingredientes de un medio definido para el cultivo de Escherichia coli. | ||
| Ingrediente | Cantidad | Comentarios |
| KH2PO4 | 3,6 g | Actúa como fuente de fosfato y como tampón |
| (NH4)2S04 | 2,0 g | Fuente de nitrógeno y azufre |
| CaCl2 | 0,01 g | Fuente de calcio, no se requiere cloruro |
| FeSO · 7 H2O | 0,0005 g | Fuente de hierro |
| MgSO4 ·7 H2O | 0,02 g | Fuente de magnesio. Como este compuesto es relativamente impuro también sirve como fuente de elementos traza |
| Glucosa | 1,0 g | Fuente de carbono |
| Agua destilada | 1000 ml | |
| Agar | 15 g | Se añade si se desea solidificar el medio |