| Tabla 8.5. Respuesta de crecimiento a distintas temperaturas entre los diversos grupos de bacterias | ||
| Clase | Propiedades | Ambiente típico |
|---|---|---|
| Psicrófilos (también llamados psicrotrofos) | Crecen de forma apreciable por debajo de 5 oC | |
| Psicrófilos estrictos | No crecen a o por encima de 20 oC | Agua de mar fría |
| Psicrófilos facultativos | Pueden crecer por encima de 20 oC | Suelo y agua |
| Mesófilos | Crecen mejor a temperaturas moderadas, de unos 37 oC | Animales |
| Termófilos | Crecen por encima de 50 0C | |
| Termófilos facultativos | Pueden crecer por debajo de 37 0C | Suelo |
| Estenotermófilos | No pueden crecer por debajo de 37 0C | Abono |
| Termólilos extremos | Crecen por encima de 80 0C (algunos por encima de 100 0C) | Fuentes termales |
Las causas de la temperatura mínima de crecimiento son más complejas, pero la mayoría tienen la misma base. Las interaciones hidrofóbicas de las proteínas se hacen más débiles cuando disminuye la temperatura, y la forma de las proteínas cambia ligeramente. La función de algunas proteínas, incluidas las que regulan el metabolismo, es particularmente sensible a dichos cambios, y por lo tanto, a bajas temperaturas, los mecanismos de regulación metabólica se distorsionan y se detiene el crecimiento. Los mecanismos de regulación de algunos termófilos comienzan a degradarse a temperaturas elevadas, del orden de 37 0C Para estos organismos, como algunas bacterias del suelo tales como Bacillus stearothermophilus, la temperatura del cuerpo humano es demasíado fría para su crecimiento. Sorprendentemente, estas bacterias se encuentran en suelos normales de climas templados, lo cual indica lo caliente que puede estar la superlicie del suelo durante un día soleado.
Presión hidrostática La presión hidrostática es la presión que se aplica a un líquido. Generalmente, la presión hidrostática se mide en atmósferas. Una atmósfera equivale a 1,0l3 Newton por metro cuadrado, la presión a la que estamos expuestos en la superficie de la Tierra. Las bacterias ordinarias, tal como Escherichia coli, crecen a presiones muy elevadas, del orden de 300 atmósferas. Las bacterias que se encuentran en el fondo del océano toleran hasta 1 500 atmósferas, suficientes para aplastar cualquier cosa excepto los recipientes de acero más resistentes. En cambio, la mayoría de levaduras no pueden crecer a presiones superiores a 8 atmósferas, una presión muy baja. Algunas bacterias, las barófilas (amantes de la presión), crecen más rápidamente a presiones superiores a 1 atmósfera y las barófilas obligadas crecen sólo a presiones superiores a 1 atmósfera.
Una presión elevada no destruye una célula microbiana como ocurriría con un ser humano, porque el agua pasa rápidamente a través de la membrana celular. De esta manera, se iguala la presión dentro y fuera de la célula. Una elevada presión puede detener el crecimiento microbiano, pero el efecto es bioquímico. El volumen molecular cambia durante el curso de la mayoría de las reacciones químicas. La presión elevada inhibe cualquier reacción química que conlleve un incremento en el volumen molecular y favorece cualquier reacción química que implique una disminución del volumen molecular. Algunas reacciones bioquímicas incrementan el volumen molecular y se hacen más lentas o prácticamente se paralizan al incrementar la presión. Sin embargo, las reacciones bioquímicas esenciales de los barófilos disminuyen el volumen molecular y se realizan más rápidamente cuando se incrementa la presión.
pH La escala de pH mide la concentración de iones de hidrógeno e hidroxilo de una solución e índica si el ambiente es ácido, por debajo de pH 7; alcalino, por encima de pH 7; o neutro, próxima al pH 7 (Capítulo 2). En general, las bacterias crecen mejor a un pH ligeramente alcalino (básico). Los hongos crecen mejor a un pH ligeramente ácido, y los protozoos y las algas a un pH neutro. sin embargo, existen excepciones, especialmente entre las bacterias. Los acidófilos (amantes del ácido), viven en ambientes con un pH extremadamente bajo. Por ejemplo, algunos acidólilos crecen en la lixiviación ácida de los desechos de las minas, en las cuales los valores de pH son muy bajos, del orden de pH 1,0 - la acidez del ácido sulfúrico. Los alcalófilos (amantes de las bases) viven en ambientes con un pH extremadamente alto. Por ejemplo, algunos alcalólilos crecen en los lagos alcalinos, frecuentes en los desiertos del oeste de Norteamérica. En éstos, los valores de pH son muy elevados, de alrededor de 12,0 - la alcalinidad de las cremas o líquidos depiladores.
La mayoría de las bacterias sobreviven en ambientes con un intervalo de pH relativamente amplio, ajustando su pH intracelular. Mediante diferentes mecanismos, bombean iones de hidrógeno fuera o dentro de la célula. Por ejemplo, Escherichia coli puede crecer en ambientes con un intervalo de pH entre 5,0 y 8,0. Pero, independientmente del pH externo, el pH interno se mantiene en un valor muy cercano a 7,6 - el valor óptimo para su metabolismo. E. coli, al igual que la mayoría de las demás bacterias, pueden realizar reacciones metabólicas vitales sólo dentro de un intervalo de pH limitado, porque muchas de sus enzimas funcionan adecuadamente sólo en un intervalo estrecho de pH (Capítulo 2).
Presión osmótica Todos los microorganismos necesitan agua líquida para crecer. Por esta razón, no pueden crecer a temperaturas inferiores al punto de congelación de su medio o por encima del punto de ebullición. Una presión osmótica elevada también priva a una célula del agua. Las membranas celulares son muy permeables al agua, de manera que el agua entra o sale de una célula dependiendo de la presión osmótica relativa, o concentración de solutos disueltos en la célula y en su medio ambiente. Las bacterias mantienen una presión de turgencia positiva, porque la presión osmótica de su contenido celular es mayor que la presión osmótica del medio ambiente (Capítulo 4). La presión de turgencia suministra la fuerza a la célula para crecer. En los microorganismos eucariotas, en lugar de la presión de turgencia, es el citoesqueleto el que proporciona la fuerza para agrandar la célula.
Si aumenta la concentración de los solutos en el ambiente externo, la bacteria debe mantener positiva la presión de turgencia. Para hacer esto, bombea hacia la célula iones potasio (K+) y/o compuestos osmoprotectores, tales como el aminoácido prolina, o sintetiza el disacárido trehalosa. Estos solutos mantienen dentro de la célula una presión osmótica superior a la presion osmótica del exterior. Sin embargo, eventualmente, este incremento en la presión osmótica interna daña enzimas esenciales e interfiere en el metabolismo de la célula. De esta manera los ambientes con una elevada presión osmótica inhiben el crecimiento bacteriano. Una manera tradicional de conservar los alimentos es añadir azúcar o sal, que incrementan la presión osmótica y, por lo tanto, impiden el crecimiento microbiano.
Aunque una elevada presión osmótica evita el crecimiento de la mayoría de las bacterias, algunas especies, denominadas halófilas (amantes de la sal), pueden vivir a concentraciones de sal extremadamente elevadas. Las arqueobacterias denominadas halobacterias se desarrollan en aguas saturadas de sal. Las salinas, sistemas con agua de mar que se deja evaporar para producir la sal de mesa, y algunos lagos desérticos tienen un color rojo intenso debido a su presencia. Estas bacterias no sólo toleran elevadas concentraciones intracelulares de sal, sino que también dependen de la misma para la estabilidad de sus cubiertas celulares; cuando se colocan en agua destilada, o en agua ordinaria, se lisan inmediatamente.
Cuando un incremento en la presión osmótica externa hace que salga agua de la célula, se produce la plasmolisis, encogiéndose el citoplasma (Capitulo 4). Las consecuencias de la plasmolisis difieren según el tipo de célula. En las bacterias, la membrana plasmática se separa de la pared celular rígida, pero generalmente, la célula puede recuperarse de la plasmolisis (a menos que la presión osmótica sea extrema) incrementando su presión osmótica interna (Figura 8.6). Los microorganismos eucarióticos, particularmente los protozoos, son más sensibles a la plasmolisis, porque carecen de una pared rígida.
LUCHANDO CONTRA EL FRIO
Puesto que los microorganismos crecen en un amplio intervalo de temperaturas, se enfrentan a desafios ambientales impensables para los seres humanos, de sangre caliente. Uno de los mayores retos es mantener una fluidez de la membrana adecuada. Las membranas están compuestas por fosfolípidos; por lo tanto, como la mayoría de los lipidos, solidifican con el frio y se hacen líquidos con el calor. Para funcionar adecuadamente, las membranas deben mantener el grado de fluidez adecuado en un intervalo de temperatura. ¿Cómo lo hacen? De la siguiente manera: la composición en ácidos grasos de los fosfolípidos de sus membranas cambia con la temperatura ambiental.
El efecto de la composidón de ácidos grasos en la fluidez de los lípidos es enorme. En el refrigerador, el aceite de oliva solídifica, pero el de maíz se mantiene fluido. Esto sucede porque el aceite de maíz, es rico en ácidos grasos insaturados (contienen dobles enlaces), y el aceite de oliva tiene ácidos grasos más saturados (no contienen dobles enlaces). A la temperatura ambiente, el aceite de maíz es más fluido que el aceite de oliva. Pero al mezclar el aceite de maíz y el de olíva en las proporciones adecuadas, se puede obtener un nivel de fluidez intermedio a temperatura ambiente, en el refrigerador o a cualquier temperatura intermedia.
Este mismo proceso ocurre en los microorganismos. Cuando disminuye la temperatura de crecimiento, una alta proporción de los ácidos grasos de los fosfolípidos de las membranas son insaturados, y así su fluidez es óptima a cualquier temperatura de crecimiento. En Escherichia coli este preciso ajuste se hace de una manera muy sencilla. Los ácidos grasos se sintetizan mediante una ruta metabólica ramificada. Una rama lleva a ácidos grasos saturados y la otra a ácidos grasos insaturados. Una enzima cerca del punto de ramificación, en la parte insaturada, es sensible a las elevadas temperaturas. Cuando aumenta la temperatura, su actividad disminuye, y se fabrican más ácidos grasos mediante la rama "saturada". Cuando disminuye la temperatura, ocurre lo contrario. El resultado es una fluidez constante a todas las temperaturas.
8.4 MEDIDA DEL NÚMERO DE MICROORGANISMOS
La medida del crecimiento y muerte de los microorganismos en el laboratorio requiere técnicas especiales. Algunas técnicas son medidas indirectas. Estas miden una propiedad - la turbidez, el peso seco, o una actividad metabólica - de la masa de células de una población. Otras técnicas son directas. Las medidas directas incluyen los recuentos directos al microscopio o recuento electrónico, el recuento en placa, o el cálculo del número más probable (NMP). (A veces la filtración es una etapa preliminar en las medidas directas.)
El recuento directo al microscopio o el recuento electrónico proporcionan un recuento de todas las células, tanto las vivas como las muertas. Un recuento de viables mide sólo las células vivas de una población, es decir, aquellas capaces de reproducirse (viable significa "que puede vivir"). Los recuentos en placa y el NMP son recuentos de viables. Cuando se usa la filtración, se obtiene un recuento de viables. Cada una de estas técnicas tienen sus ventajas y sus inconvenientes.
8.4.1 Turbidez
Debido a que todas las células de un cultivo axénico son aproximadamente del mismo tamaño, su numero es proporcional a su peso. En otras palabras, dos células pesan el doble que una célula, cuatro células pesan el doble que dos, y así sucesivamente. De esta manera, podemos estimar el tamaño de una población microbiana a partir de su peso total. Generalmente, los microbiólogos no recogen de manera laboriosa las células y las pesan. En su lugar, utilizan un instrumento óptico denominado espectrofotómetro (Figura 8.7). Un espectrofotómetro mide la cantidad de luz que transmite una solución o un cultivo líquido de células microbianas. Cuanto mayor masa de células tenga un cultivo, mayor será su turbídez, se transmitirá menos luz y la lectura en el espectofotómetro será mayor. Puesto que un espectrofotómetro mide con exactitud lo que vemos cuando examinamos visualmente un cultivo liquido, no es muy sensible con respecto al número de células bacterianas. Para que el líquido se vea turbio, el cultivo liquido debe contener alrededor de 10 millones de células bacterianas de un tamaño intermedio por mililitro y, por lo tanto, un espectrofotómetro no es útil para detectar una pequeña contaminación, es decir, la presencia de un pequeño número de células microbianas no deseadas. Al igual que para la mayoría de los cultivos bacterianos, el espectrofotómetro también puede emplearse para cultivos de levaduras.

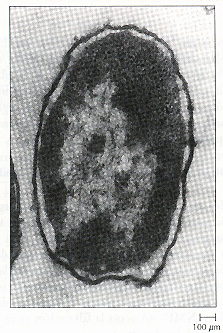
Figura 8.6 La plasmólisis de una célula bacteriana separa la membrana plasmática de la pared celular, excepto en las uniones Bayer, lugares en los que la membrana plasmática se une a la membrana externa mediante la pared celular (Capítulo 4). Esta micrografía electrónica de transmisión muestra la plasmolisis de Escherichia coli.
Generalmente, el espectrofotómetro se utiliza para estimar masa de un cultivo relativamente denso, y poder así registrar crecimiento de una población microbiana (Figura 8.7). Para medir la masa o el número de células con un espectrofotómetro, necesano, en primer lugar, preparar una curva patrón, o gráfica en la que se relacionan las medidas del espectrofotómetro con la masa celular de un determinado cultivo. Generalmente los distintos tipos de bacterias producen una turbidez diferent Posteriormente, se puede determinar a partir de la gráfica la masa celular que se corresponde con cualquier lectura en el espectrofotómetro. Las curvas patrón también pueden obtenerse para relacionar las lecturas en el espectrofotómetro con el número células de un cultivo.
¿POR QUÉ EL CHAMPÁN SE ENVASA EN UNA BOTELLA TAN PESADA?
La mayoría de los microorganismos pueden soportar elevadas presiones hudrostáticas. Pero las levaduras son una excepción sorprendente. Éstas dejan de crecer y de fermentar a tan sólo 8 atmósferas de presión. Aunque no se sabe por qué la levadura es tan sensible a la presión, este hecho constituye una ventaja para la obtención del vino. Los productores de vino alemanes explotan la sensibilidad a la presión de las levaduras para disminuir la tasa de la fermentación por levaduras que convierten el zumo de uva en vino. Así se previene la formación de calor y el daño que se puede causar al sabor del vino. Realizan la fermentación en tanques de acero cerrados y dejan que aumente la presión debido a la producción de dióxido de carbono, hasta que se modera la tasa de fermentacion.
La sensibilidad de las levaduras a la presión es incluso más critica en la obtención del champán. Las burbujas de dióxido de carbono del champán se forman en una fermentación secundaria que se realiza generalmente en la botella. Para asegurarse de que se producirá una determinada cantidad de dióxido de carbono, se añade una cantidad calculada de azúcar. No existe prácticamente riesgo de que se produzca demasiado dióxido de carbono y explote la botella. La fermentación se detiene cuando la presión en la botella alcanza las 8 atmósferas, una presión que la pesada botella de champán puede soportar perfectamente.
Como cualquier otro instrumento, el espectrofotómetro tiene ventajas y desventajas. Sus medidas son rápidas y reproducibles. Sin embargo, sólo puede utilizarse para cultivos relativamente densos, y no puede distinguir entre células muertas y vivas. Tampoco puede utilizarse con células que tiendan a formar agregados, porque dejan de suspenderse rápidamente y desaparece la turbidez.
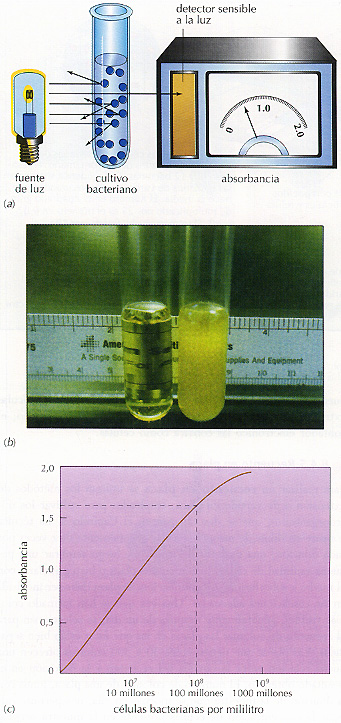
Figura 8.7 El espectrofotómetro. (a) El espectrofotómetro mide la turbidez, es decir, la cantidad de luz que transmite un cultivo, expresada en unidades de absorbancia. La célula bacteriana dispersa la luz, de manera que no es detectada por el detector sensible a la luz. (b) El tubo de la izquierda no tiene células bacterianas y está transparente. El de la derecba contiene alrededor de mil millones (109) de células por mililitro y, por lo tanto, está turbio. (c) La curva patrón relaciona la absorbancia con el número de células bacterianas por mililitro. Una vez que se obtiene, esta curva puede usarse para convertir cualquier medida de absorbancia en número de células. Por ejemplo, a partir de esta curva, una lectura de 1,6 unidades de absorbancia significa que el cultivo contiene 100 millones (108) de células por mililitro.
8.4.2 Peso seco
El número de células de un cultivo se puede medir dividiendo el peso seco del cultivo por el peso seco de una célula individual. El peso seco de las células de un cultivo se determina separándolas del medio, desecándolas y pesándolas. Para obtener una medida precisa, se requieren alrededor de 25 ml de un cultivo relativamente denso. Las células se separan mediante filtración (Capítulo 3) o mediante centrifugación. Una centrífuga es un instrumento que hace girar unos recipientes denominados tubos de centrífuga a una velocidad elevada, generando una fuerza centrífuga que hace que las partículas pequeñas, incluidas las células microbianas, se vavan al fondo del tubo. Luego, se lavan las células, se resuspenden en agua destilada y se filtran o centrifugan de nuevo. Después del segundo lavado, las células se desecan en un horno a 1050C durante unas 24 horas y luego se enfrían en un desecador, para evitar que capten la humedad del aire. Un desecador es una cámara que se mantiene con una humedad muy baja, bien químicamente o mecanicamente, y que se utiliza para desecar los materiales o para mantenerlos desecados. Finalmente, se pesan las células.
La medida del peso seco es tediosa y requiere un cierto tiempo; además, la muestra debe contener más de unos 10 millones de células, No obstante, tiene ciertas aplicaciones. Por ejemplo, debe utilizarse para construir la curva patrón que relaciona las medidas en el espectrofotómetro con las de la masa celular.
8.4.3 Actividad metabólica
La actividad metabólica puede utilizarse, mediante varios procedimientos, para medir indirectamente la cantidad de células microbianas. La tasa de formación de productos metabólicos, tales como gases o ácidos, que produce un cultivo, refleja la masa de células presente en el mismo, Asimismo, la tasa de utilización de un substrato, como el oxígeno o la glucosa, refleja la masa celular.
Finalmente, la tasa de reducción de determinados colorantes, es otra forma de estimar la masa microbiana. Por ejemplo, el azul de metileno se vuelve incoloro cuando es reducido por los componentes de la cadena de transporte de electrones de los microorganismos. Consecuentemente, en ausencia de oxígeno, que oxida el azul de metileno, la tasa de decoloración de este compuesto mide la masa microbiana. La tasa de reducción del colorante es una medida muy indirecta y, por lo tanto, no es una medida precisa de la masa microbiana. Sin embargo, la técnica puede utilizarse con materiales complejos, como el suelo o la leche, sin necesidad de usar instrumentos.
8.4.4 Recuento directo
Un recuento directo es un recuento de las células individuales de una población microbiana. El recuento directo puede hacerse visualmente, utilizando un microscopio y un porta especial denominado cámara de recuento. Existen muchos tipos de cámaras de recuento, pero la cámara de Petroff-Hauser, llamada así en honor de los que la desarrollaron, tal vez sea la más utilizada en los laboratorios de microbiología (Figura 8.8). Todas las cámaras de recuento poseen una profundidad conocida y tienen marcados unos cuadrados de dimensiones también conocidas. De esta manera, cada cuadrado que observamos al microscopio representa un volumen determinado de líquido; por ejemplo, un microlitro (0,001 µl). Se puede calcular cuántas células están presentes en 1 ml o en cualquier otro volumen del cultivo, contando las células de varios cuadrados y haciendo la media. Puesto que las células vivas y las muertas tienen un aspecto parecido observadas al microscopio, el recuento directo es un recuento total de células.
El recuento directo también puede hacerse electrónicamente, con un instrumento denominado contador Coulter. El recuento electrónico es posible porque las células microbianas no conducen la electricidad tan bien como el medio en el que están suspendidas. Se coloca en una cámara del contador un volumen determinado del cultivo y se hace pasar a través de un pequeño poro (de unos 15 µm de diámetro) a otra cámara, mediante una bomba de vacío. El poro forma parte de un circuito eléctrico, de manera que cada vez que pasa una célula a través del mismo, la conductividad del circuito disminuye y la presencia de la célula es detectada electrónicamente en el contador.
Los dos métodos principales de recuento directo - microscópico y recuento electrónico - dan resultados semejantes, pero se usan en situaciones muy diferentes. El recuento microscópico no requiere de un equipo caro, tan sólo se necesita una cámara de recuento, no muy cara, además del microscopio óptico que existe en cualquier laboratorio de microbiología. Pero es un proceso tedioso y lento. Por el contrario, el recuento electrónico requiere un equipo caro, pero es muy rápido y preciso, si las células son las únicas partículas presentes (el recuento electrónico también se usa en los laboratorios clínicos para contar las células sanguíneas). El recuento microscópico es necesario si la muestra contiene partículas extrañas, como células sanguíneas o fragmentos de suelo. Una persona que realiza un recuento microscópico puede discriminar entre las células microbianas y las partículas extrañas, pero si tienen aproximadamente el mismo tamaño, el contador electrónico las contará como células.
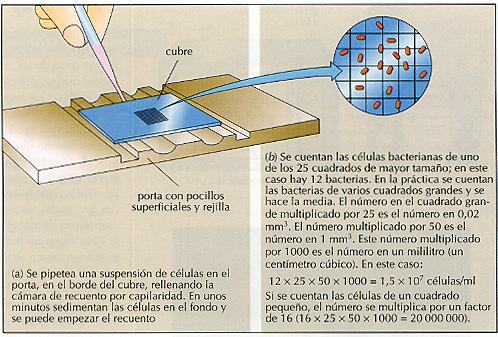
Figura 8.8 Recuento microscópico directo. La cámara de recuento de Petroff-Hauser se usa, junto a un microscopio, para realizar un recuento directo de células. Consta de un porta que tiene unos pocillos superíiciales (de 0,02 mm de profundidad). En el fondo del porta hay grabada una rejilla de 1 mm2, dividida en 25 cuadrados grandes, cada uno de los cuales está dividido en 16 cuadrados más pequeños. De esta manera, el volumen total de la rejilla es de 0,02 (un quinceavo) mm3, y cada cuadrado grande es un veinticincoavo de esta cantidad.
8.4.5 Recuento en placa
Para realizar un recuento en placa se utilizan los métodos de extensión o de vertido en placa, empleados para cultivar los microorganismos, que se describieron en el Capítulo 3. La técnica consiste en diluir de manera seriada, generalmente diez veces por cada dilución, una muestra del cultivo y luego sembrar una pequeña cantidad de cada dilución en una placa o bien mezclarla con el medio a sobrefusión. A continuación, la placa debe ser incubada en las condiciones adecuadas. Una vez que se han formado colonias visibles, generalmente después de un día, se seleccionan para el recuento de colonias las placas en las que éstas están bien separadas. Las placas que tienen entre 30 y 300 colonias ofrecen una buena relación entre la rapidez del recuento y la precisión en el resultado obtenido. El número de colonias de una placa, junto con la dilución de la muestra que se inoculó en ella, nos permite calcular la concentración de células presente en la muestra original (Figura 8.9). El recuento en placa es un recuento de viables, Se basa en el principio de que una única célula viable originará una colonia visible, cuando se siembre en una placa de agar.
La ventaja del método de recuento en placa es su gran sensibilidad. Si se utiliza un medio y unas condiciones de incubación adecuadas, puede detectarse incluso una única célula viva. Ademas, el recuento en placa no requiere un equipo complicado. Un inconveniente es que el recuento en placa es lento y tedioso y no es muy preciso, porque la precisión depende del recuento de un número elevado de colonias. La precisión aumenta con el número de colonias que se recuentan, ya que disminuye el error debido al muestreo.
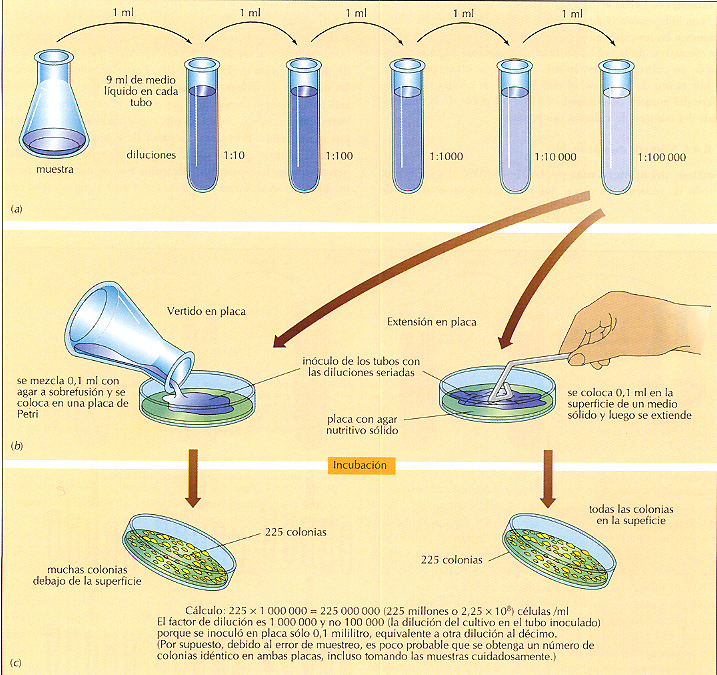
Figura 8.9 Un recuento en placa es una medida directa y proporciona un
recuento de viables. En primer lugar, la muestra se diluye seriadamente, transfiriendo
1 ml de la muestra a 9 ml de medio estéril y se mezclan adecuadamente.
Este proceso se repite basta obtener una dilución apropiada en este ejemplo,
1:100000 (10-5). Posteriormente se añade 0,1 ml a una placa de
agar nutritivo, bien extendiéndolo en la superficie de la misma (método
de extensión en placa) o mezclándolo con el medio (método de
vertido en placa). Las placas se incuban y se recuentan las colonias que se desarrollan.
Debido a razones estadísticas, las placas deben contener entre 30 y 300 colonias.
En este ejemplo, la placa tiene 225 colonias.